GMP飞行检查是对药企进行有效监管的形式之一,其目的在于进一步加强对药品生产企业的监管力度,强化安全风险防控,巩固药品GMP再认证成果,进一步提高药品生产质量管理水平,消除药品质量安全隐患,确保药品质量安全。
质量管理模块作为GMP检查六大系统的重要环节及核心内容,对于强健的制药质量体系来说至关重要。
那么,如何建立、执行有效的质量管理制度来降低飞检时的合规风险药品质量风险呢?常用的抓手有变更、偏差、CAPA和年度质量回顾等。
变更管理
变更在药品生产与质量管理过程中对产品质量起到重要的影响作用,因此是被审计的重点内容之一。而变更管理恰好是药企在质量管理中比较薄弱的环节,变更越来越受到企业的重视。
01
变更的定义
变更是指即将准备上市或已获准上市的药品在生产、质量控制、使用条件等诸多方面提出的涉及来源、方法、控制条件等方面的变化。
02
变更的目的
任何药品生产企业都应该建立、执行与药品生产过程有关的变更控制系统,以保证产品生产的各个环节的相关变更得到及时运行、批准、回顾和记录。
03
变更的流程
(
1)涉及部门
可能涉及到药品生产企业内部的所有部门,包括生产部、物流部、质量部、研发部、销售部、市场部等。
(2)变更申请
确认变更后,申请者填写“变更申请审批表”,附有详细的变更实施方案,经本部门负责人同意后,交至质量部门。
(3)变更申请的评估和审核
质量部门对提出的变更进行初步审核,如有必要,可召集相关部门对变更风险进行评估,给出审核意见。若变更未被批准,需将意见反馈到申请部门。若变更被批准,按照相关法规和相应的技术指导原则的要求进行变更前的准备工作,制定实施计划。
(4)变更实施前的准备工作
变更被批准后,相关部门按实施计划进行准备工作。包括产品变更前后性质和指标对比、工艺验证研究、产品稳定性研究、制定新的管理制度、修改现有管理制度、对相关人员进行培训等。对于重大变更,做好药品监管部门的备案或批准工作。
(5)变更跟踪、评价与实施
质量部门对变更的执行结果进行确认和评价,包括变更实施情况、与变更相关的文件变更情况、变更培训等变更追踪。
(6)变更的反馈与评估
跟踪工作结束,质量部门应将变更申请、变更批准情况、变更实施的情况及时反馈给相关部门和人员。
(7)变更文件归档
所有被批准实施或被否决的变更文件,以及相关的资料都必须建立相应的文档,由专人保管。
偏差管理
偏差管理是GMP检查的重点,同时也是GMP检查中容易发现缺陷的要点。偏差管理是一个窗口,它反映了公司的质量体系是否能承担它的法律责任的能力。
01
偏差的定义
偏差,是一种非预期事件,可能会影响产品的安全、质量和有效性。根据ICH定义,偏差是指对批准指令或规定标准的任何偏离。任何与已批准的质量标准、检验方法、操作规程、管理文件、工艺规程、环境和生产全过程中各种相关影响因素不相符的情况都视为偏差。
02
加强偏差管理的原因
预防偏差对药品安全造成的风险;防止问题的重复发生;增加对工艺的了解,推动技术、质量和流程的不断革新和改进
03
偏差的处理流程
•发生偏差时,及时报告、调查分析、影响评估
•制定有效的纠正、预防措施,避免偏差的再次发 生
•完成纠正行动和偏差报告,并将偏差记录归档
•偏差系统的趋势分析和持续改进 ,以确保产品的质量符合GMP要求
04
偏差中各个部门的职责
(1)偏差发现部门和质量部门
•立即记录问题发生的详细过程,报告质量部门
•质量部对偏差进行分类
•提出需要立即执行的纠正措施
(2)偏差发现部门和质量部门
•及时调查偏差的根本原因
•制定纠正和预防措施
(3)相关部门
•积极协助有关部门调查偏差产生原因
•严格按偏差处理意见进行偏差处理
•对产品质量进行评估
•按时完成纠正和预防行动,避免类似的偏差再次发生
(4)质量部门
•批准偏差的根本原因
•批准纠正和预防行动
•批准产品质量影响评估
•追踪整改行动的完成情况
•对偏差的整改效果做出评估
CAPA(纠正与预防措施)
CAPA体系是质量管理模块的一个核心组成部分,建立有效的CAPA体系,能有效地帮助制药企业提升质量体系管理,实现产品质量的持续改进。
01
CAPA的定义
根据美国FDA的定义,CAPA计划的目的是收集信息、分析信息、识别和调查产品和质量问题,并采取适当有效的纠正和预防措施,以防止其再次发生。
纠正措施:防止再次出现已确定的问题。
预防措施:防止再次发生类似的潜在问题。
02
CAPA的目的
建立CAPA系统,找到导致缺陷的根本原因,采取预防措施,防止类似缺陷的反复发生,对各种途径发现的单一缺陷进行统计、分析评估、采取主动型预防措施、追踪管理等一系列管理活动,从而防止类似缺陷在其他方面、不同产品线的重复出现。
03
CAPA的处理流程
(1)发现缺陷问题、原因分析、风险评估
当发现产品缺陷问题及时向质量部门反馈,质量部门进行调查并分析原因,再进行风险评估,确认问题的严重程度及是否需要采取整改措施。
(2)CAPA的制定
当发现问题或隐患的时候,应向质量部门提出纠正与预防措施。质量部门对措施进行整理汇总,经批准后分发至相关部门进行执行。
(3)CAPA的执行与追踪落实
各相关部门应按照批准后的CAPA严格进行整改,并按照计划的时间完成,质量部门应根据具体的完成时间计划进行追踪落实各相关部门的整改完成情况,并将跟踪结果形成文件,定期报告管理层。必要时,上报药品监管部门。
(4)CAPA的有效性评估
当所有的整改项目完成后,质量部门应对CAPA的有效性进行评估,若发现不合理,应组织相关部门进行讨论。若评估有效,则关闭CAPA。
另外,质量部门每年应在年度质量回顾中对本年度的CAPA进行回顾,包括对CAPA的有效性以及实施后的效果回顾。
年度质量回顾
产品质量回顾是药品生产质量管理中的重要环节,是GMP认证必检的项目。
01
产品质量回顾定义
产品质量回顾是药品生产企业定期回顾分析与产品相关的一系列的生产和质量数据,评价产品生产工艺的一致性,分析相关物料和产品标准的适用性,以识别其趋势,并对不良趋势加以控制,进而确保产品工艺稳定可靠,符合质量标准规定,并为持续改进产品质量提供依据的质量活动。
02
产品质量回顾目的
产品质量回顾核心是评估确认当前生产工艺的一致性,物料与成品标准的适宜性,及时识别产品质量趋势和改进点,不断提升质量,保证持续质量改进。
03
产品质量回顾的工作流程
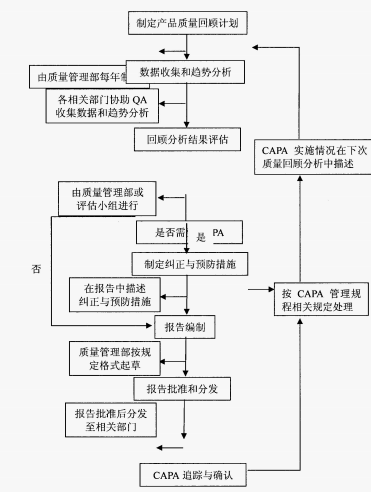
(1)制定年度产品质量回顾计划
质量部门制定年度产品质量回顾计划,分派到各职能部门,规定完成时限。
(2)数据收集和趋势分析
各职能部门按要求收集产品相关信息和数据,按时交至质量部门。质量部门对数据进行汇总和整理,并进行趋势分析,再组织会议讨论、分析,并对重大事项进行风险评估。
(3)分析回顾结果,制定纠正与预防措施
质量部门对会议讨论结果作出分析与总结,形成报告,并制定相应的纠正与预防措施。
(4)报告编制及分发
报告编制完成,经批准后,分发至相关职能部门。
(5)CAPA(质量纠正与预防)追踪与确认
各职能部门按照相关要求在限定的时间内实施改进措施,并将执行情况汇总在下年度回顾报告中。
总结
药品质量关系到民生的健康与安全,在药品生产的过程中,任何一个小细节都不容忽视。
质量管理模块作为GMP检查六大体系模块的重要环节及核心内容是支撑强健的制药质量体系的基石。
建立健全、有效的质量管理体系,是制药企业发展和产品质量的重要保证。作为制药行业的一分子,每个人都要坚守制药人的责任和使命,为药品的质量安全保驾护航。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..