2023年8月31日,FDA发布标题为“CDER的质量管理成熟度(QMM)计划:实践领域和原型评估方案开发”的白皮书(中英文版本可点击下面的小程序卡片阅览),这是对2022年QMM白皮书计划的延续。
书中表示,CDER正在建立一个计划,以促进药品生产场地的QMM。QMM计划旨在鼓励药品生产商实施超出现行CGMP要求的质量管理实践。该计划有四个目标:
1. 培养良好的质量文化理念
2. 识别具有先进质量管理实践的场地,并认可努力持续改进质量管理实践的场地
3. 确定可以加强质量管理实践的领域,并提供关于提升机会的建议
4. 最大限度地降低产品可用性的风险,以确保可靠的市场供应
2020年10月至2022年3月期间,CDER与第三方合同商合作执行了两个旨在评估药品生产场地QMM的试点项目。一个试点项目涉及7家负责生产成品制剂的国内场地,另一个包括8家生产原料药(API)的国外场地。这些试点在制定评估 QMM 的方案、理解评估人员行为以及收集参与者对评估问题、报告和结果的反馈方面为 CDER 提供了宝贵的见解。
2022年11月2日,药物科学与临床药理学咨询委员会召开会议,考虑CDER的QMM计划对制药行业、药品短缺和供应链可靠性的潜在影响。咨询委员会全票通过,表示支持CDER的QMM计划的发展。为决定 QMM 计划的发展方向,CDER运用了两个试点项目的结果,吸取了经验教训,并考虑了咨询委员会的讨论和意见。
原型评估方案实践领域
实施该计划的下一个关键步骤是制定评估生产场地QMM的方案。该原型评估方案将在2024日历年进行测试和完善。CDER正在开发一个涵盖五个实践领域的原型评估方案:
1. 管理层对质量的承诺
2. 业务连续性
3. 先进的药品质量体系(PQS)
4. 卓越的技术
5. 员工敬业度和授权
白皮书中对每个实践领域进行了描述,提供了评估中考虑的要素示例,并解释了为什么每个实践领域对 QMM 而言是重要的。本文简要概述这五个实践领域的关键要素,更多细节描述可参考白皮书原文。
1. 管理层对质量的承诺
可在本实践领域审评的要素包括管理层如何优先考虑和制定质量目标和政策,以及如何有效地将这些目标传达给组织中的所有级别的员工。评估还可能涵盖管理层审查的有效性,包括审查的频率、审查数据的深度以及如何使用审查过程的结果来进行持续改进。
2. 业务连续性
可在本实践领域审评的要素包括,场地如何有效地在其供应链中建立冗余,从而即使在原料或包装材料的可用性发生突然变更的情况下,也可以继续运营。这与场地对其供应链固有风险的理解和缓解程度(例如,通过制定有效的风险管理计划)有关。评估还可能涵盖场地的预防性维护计划的有效性,由于设施或设备的计划外维护而导致生产中断的频率,以及他们能够以多快的速度克服这些中断以确保产品的稳定供应。
3. 先进的PQS
本实践领域可能涉及的要素包括场地的质量风险管理(QRM)方法,工艺性能监测和产品质量监测系统的基本原理,了解场地如何利用纠正和预防措施(CAPA)以及来自工艺性能和产品质量监测活动的信息来改进生产操作,如何确定纠正或预防措施有效的基本原理,以及场地的变更管理系统有效地评估、批准和正确实施变更的能力。
4. 卓越的技术
本实践领域可能涉及的要素包括,场地管理其组织中的信息的有效性如何,以确保数据可归属、清晰可辨、同步、原始、准确、完整、一致、持久,并且所有需要的人都可以使用,无论是什么格式(例如,纸质系统,电子系统)。评估还可以审查场地在以下方面的有效性:综合不同来源的信息,确定拟定的解决方案(例如,设备或软件的技术升级)符合其目的,以及确保解决方案的有效实施,以增强业务运营或生产工艺。
5. 员工敬业度和授权
本实践领域可能涉及的要素包括,员工提出建议以改进业务或生产运营的意愿如何,以及领导层是否创造了一种鼓励员工分享想法和观点的环境。评估还将衡量员工对其角色对产品质量和患者安全的影响的理解。敬业的员工将寻求并获得机会来提升他们的专业知识,并在组织内拥有清晰的职业发展道路。
解释关于 QMM 计划的可能误解
QMM评估不用于评估CGMP合规性。QMM评估不是FDA检查权限的一部分,参与QMM计划是自愿的。QMM评估的重点是评估场地内的行为、实践和质量文化。QMM水平越高,表明工艺能力和性能越高,可导致药品短缺的质量失败的风险越低。
QMM评估生产场地,不评估产品质量。QMM评估不能也不会评估具体产品的质量。FDA通过评估监管申请、上市后质量缺陷报告(例如,现场警示报告、生物制品偏差报告、MedWatch报告、消费者投诉)、取样和检测结果以及通过CGMP检查来评估整个生命周期内的产品质量。
成熟度与场地规模或使用时长以及所生产产品的类型或数量无关。QMM评估的重点是评估场地是否存在质量文化,以及这种理念如何反映在所采用的质量实践中。因此,这些评估不是针对特定产品的,场地的成熟度不取决于场地规模或使用时长,以及生产、检验、加工、包装、贴签/重新贴签或贮存的产品类型或数量等因素。
QMM评估不同于质量量度的收集。质量量度(QM)是由场地收集和回顾的定量数据,以确定生产工艺和系统的能力和有效性。另一方面,QMM评估是定性的并关注方法,包括理解场地为什么选择和确定具体的量度进行监测,以及他们如何利用数据来推动持续改进。
QMM不是额外的负担或要求。事实上,它是场地质量体系不可或缺的一部分。大多数场地已经具备与 QMM 相一致的工艺和实践。场地积极主动的持续改进自然会实现更高水平的QMM。质量文化应是质量体系不可或缺的一部分。此外,提升质量体系的益处是众所周知的,可以带来长期的成本节约。每个场地就如何以及在何处投入资源做出决策,该决策应考虑投入的回报,而不仅仅是最开始的成本。
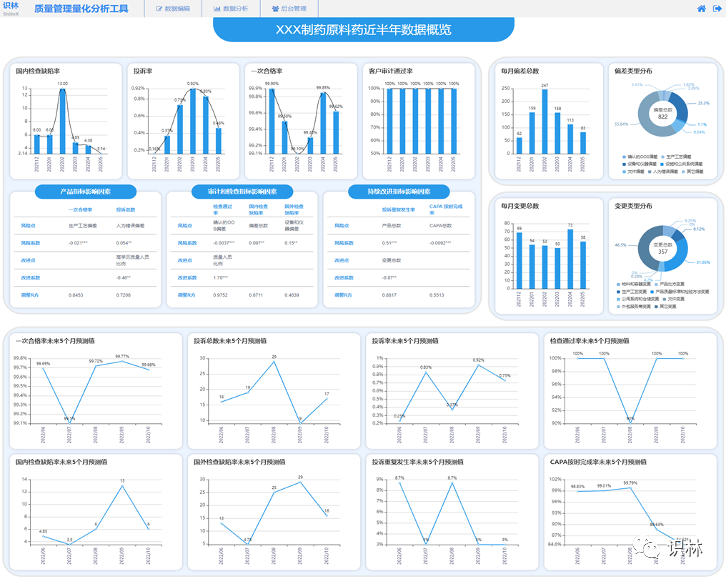
质量管理量化工具
践行质量管理成熟度计划需要基于严谨数据和分析方法的工具。为响应业界和药监部门的号召,识林团队在被FDA和业界所认可的科学研究的基础上,开发出了质量管理量化分析工具。该工具的主要功能有以下三点:
A. 企业仪表盘:提供实时的企业仪表盘,便于企业高层对当前的质量管理水平一目了然,对于集团化企业,提供可切换的各分公司仪表盘对比;
B. 质量管理水平月度监测:按月对质量管理的关键指标做可视化、影响因素、趋势预测等分析,并为指标的整改提供针对性建议;
C. 质量管理年度总结:通过分析当年数据和对比往年数据,从产品、合规、持续改进等维度量化质量管理水平,识别风险点,为关键绩效指标提供整改建议,为进一步改进质量管理体系和确保产品质量提供未来计划;对于集团化企业,还将提供各分公司年度分析报告对比。
结论
QMM计划旨在促进良好的质量文化,认可具有稳健质量管理实践的场地,并为质量管理实践可以加强的领域提供支持和建议。通过该计划,行业参与者和QMM评估人员可以共同推动制药行业的主动持续改进,最终实现更可靠的药品供应和积极的患者结果。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..