8 月 21 日,CDE 官网显示,礼来制药 GLP-1R/GIPR 双重激动剂替尔泊肽注射液的一项新适应症在国内申报上市(受理号:JXHS2300079/80/81/82)。
替尔泊肽此前已经在美国、欧洲、日本获批上市治疗 2 型糖尿病,在这些地区,该药的减重适应症也正处于上市申报当中。
国内的首个上市申请同样针对 2 型糖尿病,于 2022 年 9 月获受理,目前仍在审评中;而本次申报的适应症为:用于在低热量饮食和增加运动基础上改善成人肥胖或伴有至少一种体重相关合并症的超重患者的长期体重管理。

截图来自:CDE 官网
替尔泊肽自上市以来势不可挡。其放量速度远大于包括度拉糖肽、司美格鲁肽在内的其他同领域上市产品。去年 9 月才刚上市,今年上半年就已经大卖 15.48 亿美元,进入全球药品销售额 TOP100 榜单,直接空降 50 位,这还是在潜力更不容小觑的肥胖、心衰等代谢适应症未上市的情况下。
排行榜相关阅读 >> 2023 上半年全球药品销售额 TOP100
替尔泊肽初上市放量速度对比
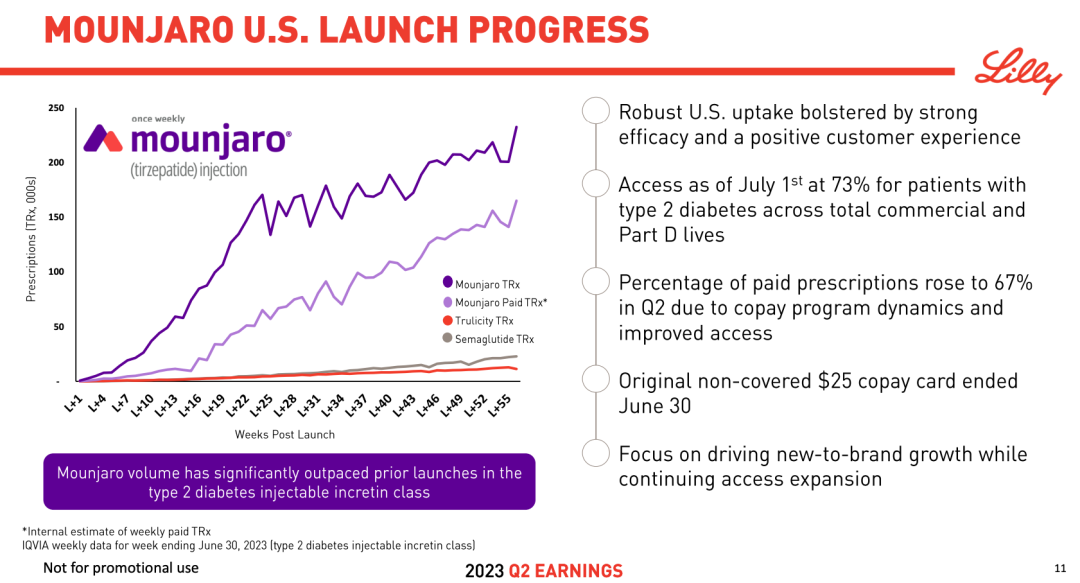
截图来自:礼来 2023Q2 季报资料
Tirzepatide 用于成人长期体重管理适应症的注册申请是基于 26 项 tirzepatide 临床研究结果,其中包括中国肥胖或超重注册临床试验 SURMOUNT-CN。
SURMOUNT-CN (NCT05024032) 是一项多中心、随机、双盲、平行、安慰剂对照的 III 期临床研究,研究纳入肥胖 (BMI≥28 kg/m²) 或伴有至少一种合并症的超重 (BMI≥24 kg/m²) 的中国成人患者,旨在低热量饮食和增加运动的基础上对比 tirzepatide 与安慰剂在体重减轻方面的有效性和安全性。
研究入组了 210 名中国患者 (基线体重均值为 91.8 kg、BMI 均值为 32.3 kg/m²),以 1:1:1 的比例随机分组,分别接受 tirzepatide 10 mg 或 15 mg 或安慰剂每周一次治疗。共同主要终点为在 52 周时 tirzepatide(10 mg 和/或 15 mg) 相较于安慰剂在体重的变化百分比和达到体重减轻 ≥5% 的患者比例方面的优效性。SURMOUNT-CN 达到主要终点和所有关键性次要终点,该试验中 tirzepatide 的总体安全性与先前试验报道相似,未发现新的安全性信号。
共同主要终点结果显示,治疗 52 周时, tirzepatide 10 mg 和 15 mg 治疗组体重自基线的平均变化百分比分别为 -14.4% 和 -19.9%,优效于安慰剂组 (-2.4%);tirzepatide 组 (10 mg,91.4%;15 mg,92.7%) 达到体重减轻 ≥5% 的患者比例优效于安慰剂组 (29.4%)。此外,tirzepatide 组 (10 mg,48.6%;15 mg,72.1%) 达到体重减轻≥15% 的患者比例也优效于安慰剂组 (2.9%)。
Tirzepatide 的总体安全性与已知的 GLP-1 受体激动剂相似,最常见的不良反应为轻度至中度胃肠道不良反应,主要发生在剂量递增期,随持续给药而降低,绝大多数患者可耐受并坚持治疗。SURMOUNT-CN 的结果将于今年 10 月在欧洲糖尿病研究协会(EASD)学术年会上公布。
当前据 Insight 数据库显示,替尔泊肽已经公布了 5 项肥胖症关键临床试验积极结果:SURMOUNT-1~4,和针对中国人群的 SURMOUNT-CN。
替尔泊肽已公布结果的减重关键临床试验
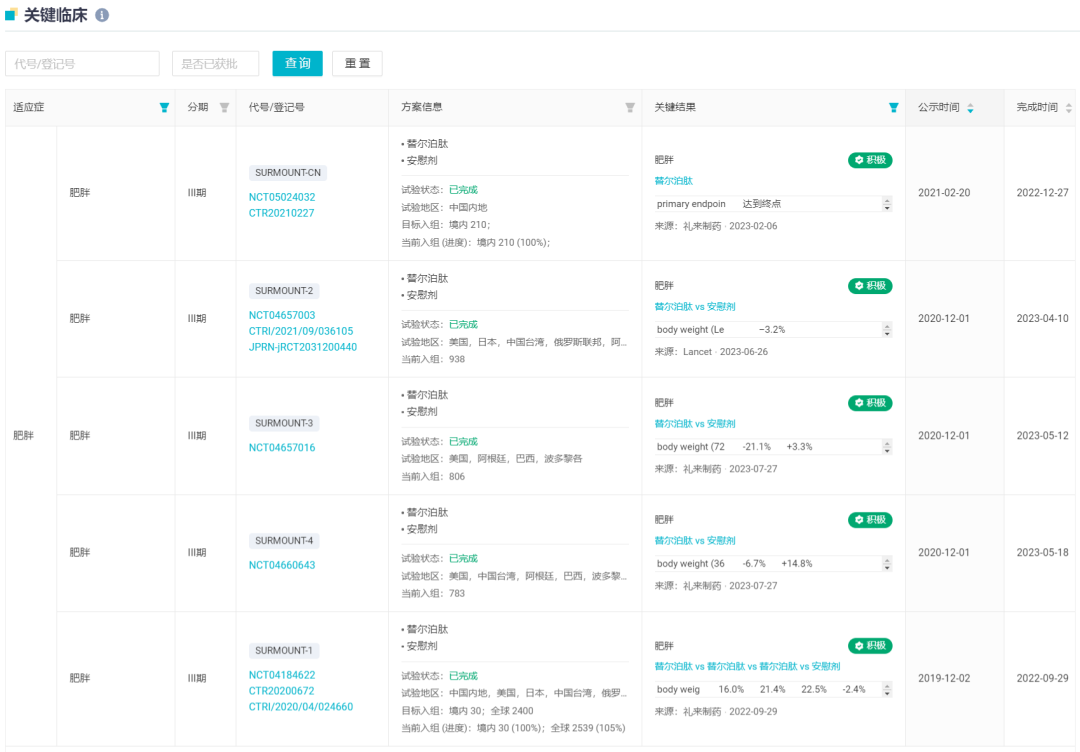
截图来自:Insight 数据库网页版(http://db.dxy.cn/)
据礼来官方披露,针对 Tirzepatide 长期体重管理的 SURMOUNT 系列 III 期临床开发项目于 2019 年底开始,在 6 项临床注册研究中招募了超过 5,000 名肥胖或超重患者,包括 4 项全球研究、1 项中国研究及 1 项日本研究。此外,正在成人肥胖或超重患者中进一步开展 IIIb 期临床试验 SURMOUNT-5 研究,旨在对比 tirzepatide 与司美格鲁肽 2.4 mg 治疗 72 周的有效性和安全性。
Insight 数据库显示,替尔泊肽的 SURMOUNT 系列研究共登记有 9 项 III 期临床试验,除上述之外还包括用于肥胖患者发病率和死亡率的 SURMOUNT-MMO、用于睡眠呼吸阻塞的 SURMOUNT-OSA。其中 SURMOUNT-MMO 目标入组人数高达 15000 人之多,当前已入组 300+ 人。
替尔泊肽的 SURMOUNT 系列研究
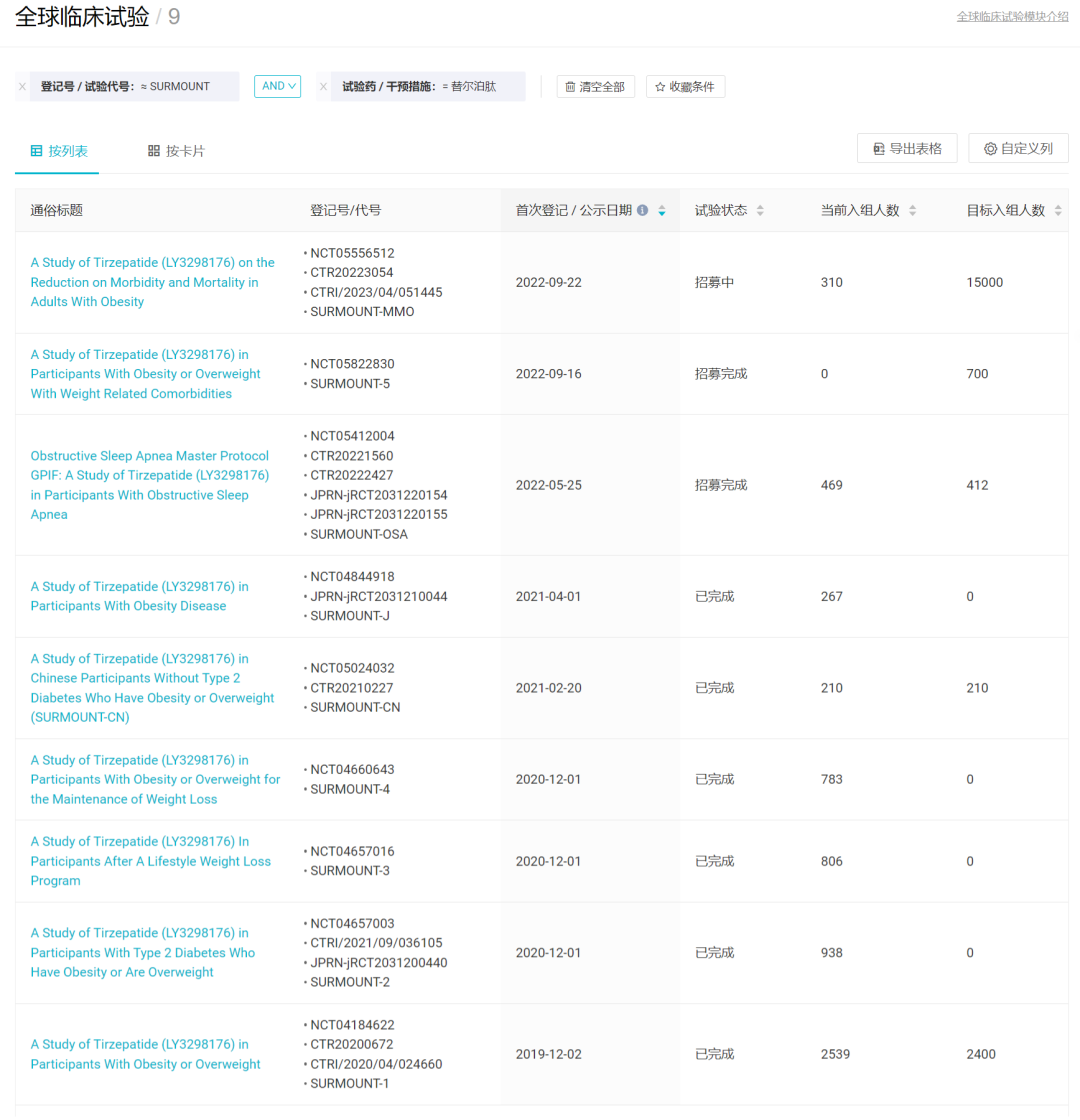
截图来自:Insight 数据库网页版
礼来在 GLP-1 赛道还布局有全球进度最快的口服 GLP-1R 激动剂 Orforglipron 和 GLP-1R/GCGR/GIPR 三靶点激动剂 Retatrutide,当前都在 III 期临床研发当中,首发适应症已经转向了肥胖领域。
Orforglipron 全球已登记的 III 期临床
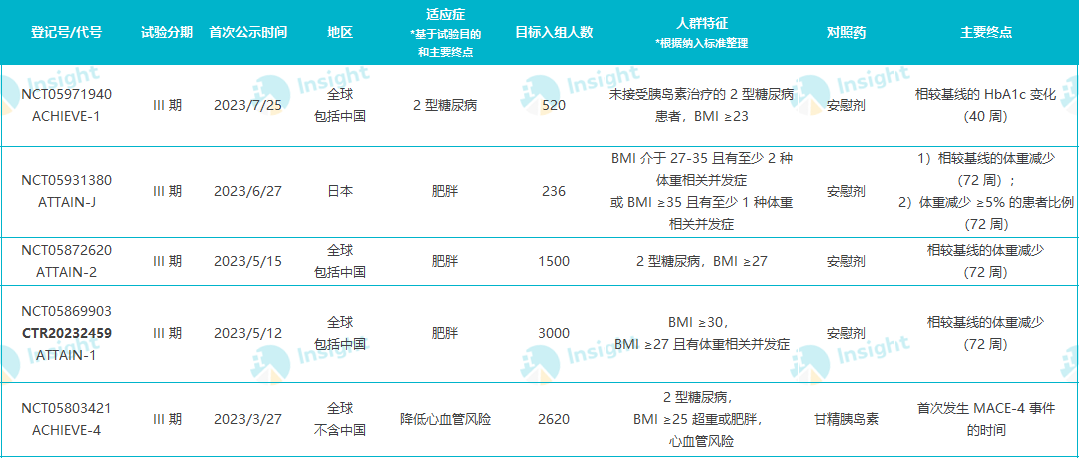
Retatrutide 全球已登记的 III 期临床
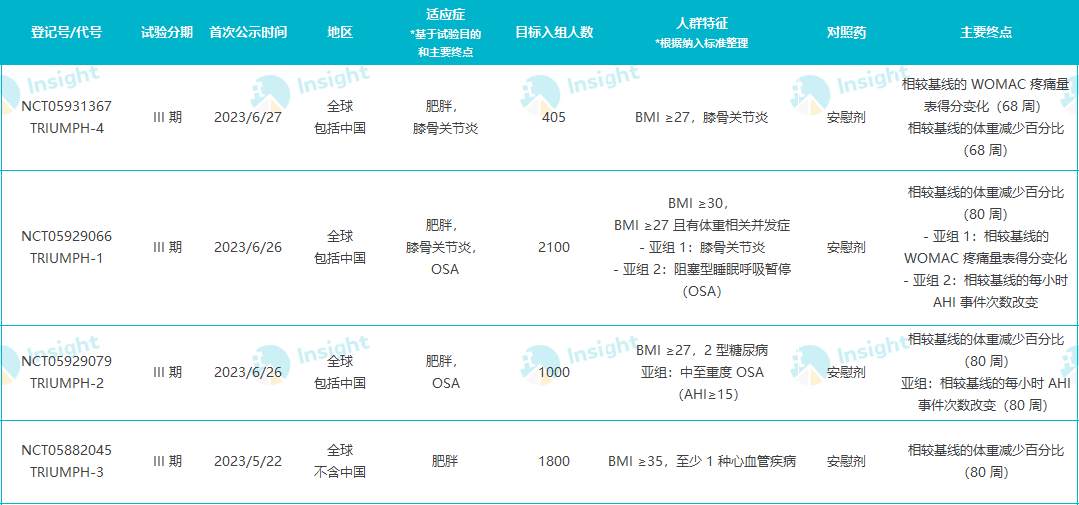
表格数据整理自 Insight 数据库
内容参考:CDE 官网,Insight 数据库,礼来制药官微,礼来制药 Investors
封面来源:企业 Logo
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..