今日(8月3日),中国国家药品监督管理局(NMPA)官网最新公示,烨辉医药申报的ROCK2抑制剂甲磺酸贝舒地尔片上市申请已获得批准。根据烨辉医药此前发布的新闻稿,该药本次在中国获批用于治疗慢性移植物抗宿主病(cGVHD)。值得一提的是,贝舒地尔(belumosudil)已于2021年在美国获批治疗12岁以上的cGVHD患者,是首款获FDA批准的ROCK2抑制剂。

![]()

截图来源:NMPA官网
造血干细胞移植是治疗血液或骨髓癌症的常见手段。然而,在cGVHD患者中,移植的免疫细胞会攻击宿主的健康细胞,从而带来一系列严重的副作用。据估计,大约有30%-70%接受造血干细胞移植的患者会出现cGVHD症状,包括炎症反应和多器官组织纤维化。
Belumosudil是由Kadmon Holdings公司开发的一款ROCK2激酶抑制剂,ROCK2介导的信号通路在调节炎症和纤维化反应中具有重要作用。Belumosudil能通过减轻STAT3的磷酸化,加强STAT5的磷酸化,从而下调过度活化的T辅助细胞(Th17),并增强调节性T细胞(Treg)功能,进而重建免疫平衡。
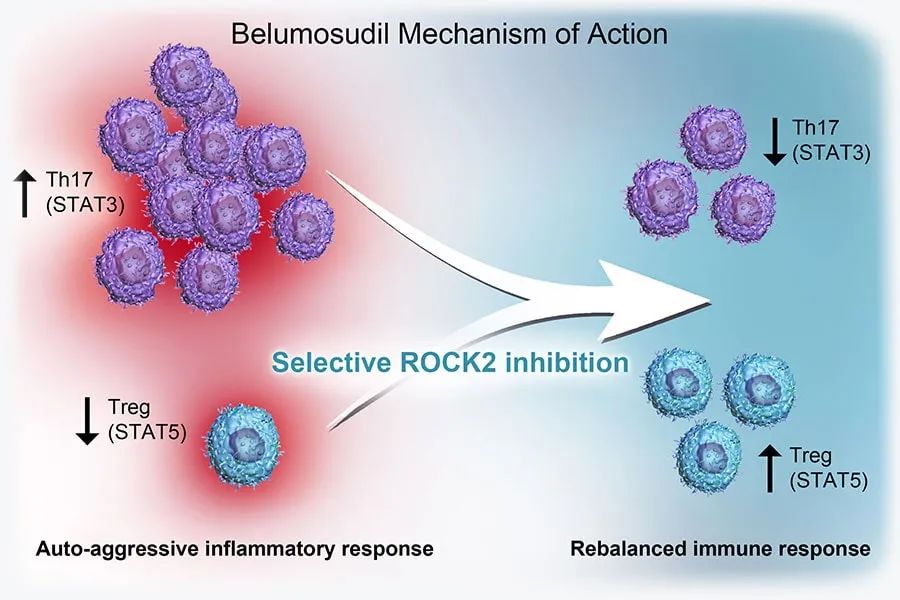
▲Belumosudil作用机制图示(图片来源:参考资料[4])
2019年,烨辉医药与Kadmon Holdings达成战略合作,成立合资公司BK Pharmaceuticals在中国开发和商业化belumosudil用于治疗GVHD。值得一提的是,2021年9月,Kadmon Holdings已被赛诺菲(Sanofi)以约19亿美元收购。
由于治疗效果显著,belumosudil曾被FDA授予突破性疗法认定、孤儿药资格和优先审评资格,用于治疗cGVHD患者。2020年,NMPA也将belumosudil纳入突破性治疗品种,拟用于至少经过一线系统治疗的慢性移植物抗宿主病患者的治疗。2021年7月,FDA批准belumosudil用于治疗12岁以上的慢性移植物抗宿主病患者,这些患者曾接受过两种前期全身性治疗。
Belumosudil的治疗效果已在一项名为ROCKstar的随机、开放标签、多中心关键性临床试验中得到了验证。在该研究中,共计有65名患者接受了belumosudil的治疗。试验结果显示:belumosudil治疗组患者的总缓解率(ORR)为75%,完全缓解率为6%;出现首次缓解所需的中位时间为1.8个月,62%获得缓解的患者在缓解后至少12个月不需要使用新的全身性疗法,中位缓解持续时间为1.9个月。
参考资料:
[1]2023年08月03日药品批准证明文件送达信息发布. Retrieved Aug 3 ,2023, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20230803153813176.html
[2]烨辉医药宣布在中国提交Belumosudil治疗慢性移植物抗宿主病的新药申请(NDA). Retrieved Nov. 24,2021, from https://mp.weixin.qq.com/s/qiOtDcFY8nKyLXz_43LbUA
[3] FDA approves belumosudil for chronic graft-versus-host disease. Retrieved July 16, 2021, from https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-belumosudil-chronic-graft-versus-host-disease
[4] Kadmon Holdings公司官网 . From https://kadmon.com/clinical-pipeline/pipeline/#about-kd025
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..