从一个类别药物的市场前景来看,过去一个月最为受到关注的,或许是AD领域的Lecanemab获得完全批准,有望打开Aβ抗体全面商业化的大门;但要论FDA批准的新分子实体,针对RSV的长效抗体Beyfortus才是7月的明星。
经过半年多等待,赛诺菲和阿斯利康先后在欧洲、加拿大等地拿到上市许可后,如愿将Beyfortus送进美国市场。无独有偶,7月另一款被FDA批准的AML新药Vanflyta,全球首批也不在美国。甚至,从Vanflyta最早在日本上市,到此次得到FDA放行,中间隔了4年之久。
被誉为创新药的沃土的美国,要落后其他监管市场了吗?显然,这是个武断的结论。但从这些时间差,业界也确实可以感知到,当下FDA对药物疗效和安全性的“再平衡”。
围绕设立近30年并且争议走高的加速批准制度改革尚在进行时,2022年FDA批准的新药数量跌破50款。FDA的迟疑有很多方面原因,例如,一众国产PD-1抗体就由于美国患者获益存疑而被拒之门外,尤其是在本土已经出现同机制药物的情况下;也有副作用因素,这被部分人士认为FDA面对RSV抗体更谨慎的考量点。
不过,如果视角放大,RSV赛道已经取得历史性突破,两款RSV疫苗正式获得FDA批准。在更多的未被满足治疗领域,可以期待FDA的大有作为。
1
Beyfortus:面向婴幼儿的长效抗体
7月17日,阿斯利康和赛诺菲联合开发的RSV抗体Beyfortus(nirsevimab)获得FDA批准上市,用于预防婴幼儿RSV引起的下呼吸道疾病。具体年龄段上,该药覆盖新生儿和在第一个RSV季节出生或进入第一个RSV季节的婴儿,以及在第二个RSV季节仍易患严重RSV疾病的24个月以下儿童。
RSV是造成下呼吸道感染的最常见原因,也是导致儿童死亡的重要原因。WHO估计,每年全球有16万儿童死于RSV感染。
去年11月4日,Beyfortus在欧盟迎来全球首批,用于新生儿和婴儿,帮助他们在首个RSV流行季到来时预防RSV下呼吸道感染疾病。这是首个可广泛应用于婴儿人群的单剂次被动免疫制剂。4月,加拿大也批准了Beyfortus上市申请。
Beyfortus的安全性和有效性得到3项临床试验的支持。疗效的关键指标是需要治疗的RSV下呼吸道感染的发生率,在Beyfortus给药后150天内进行评估。
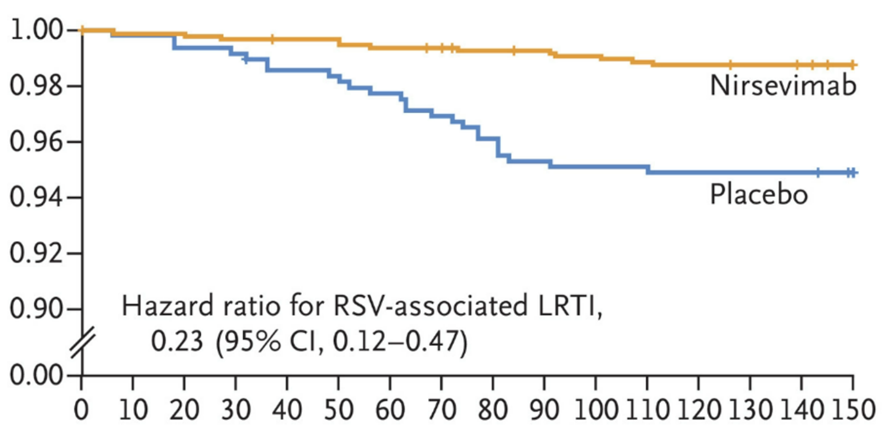
单机注射Beyfortus在150天内一直维持了良好的RSV防护作用(图源:药通社)
试验之一纳入了1453例在首个RSV流行季节出生或进入首个RSV季节的早产儿(胎龄≥29周且<35周)。在接受Beyfortus注射的婴儿中,2.6%出现MA RSV LRTI,而接受安慰剂注射的婴儿为9.5%。与安慰剂相比,Beyfortus使下呼吸道感染的风险降低了约70%。
另一项试验的主要分析组包括1490例足月和晚期早产儿(胎龄≥35周出生),其中994例接受Beyfortus单次给药,496例接受安慰剂。在接受Beyfortus治疗的婴儿中,1.2%出现下呼吸道感染,而接受安慰剂治疗的婴儿的感染率为5.0%。与安慰剂相比,Beyfortus使下呼吸道感染的风险降低了约75%。
剩下一个试验中的安全性和药代动力学数据,支持Beyfortus用于24个月以下的儿童,这些儿童在第二个RSV季节仍易患严重RSV疾病。
去年以来,各家RSV在研管线纷纷进入后期阶段。如果说FDA接连批准两款成人疫苗填补了RSV预防缺失已久的一块拼图,那么抗体药物的上市,则从另一个角度构筑业界应对RSV感染的屏障。
受限于先天性免疫和适应性免疫没有发育完全,加之婴儿出生与RSV感染的时间窗较窄,RSV疫苗所能刺激婴儿达到的抗体水平有限。2013年,Pre-F蛋白结构被解析后,以Pre-F为基础的RSV预防用被动免疫制剂研发项目涌现,Beyfortus便是这种被动免疫策略的代表之一。
2017年3月,赛诺菲和阿斯利康达成协议,基于后者专有的YTE半衰期延长技术,共同开发和商业化Beyfortus。这种技术旨在对中和抗体进行优化,突破了早年获批的另一款RSV抗体Synagis面对的局限——后者的保护周期约1个月,并受限于高危婴儿范围。
除了在欧洲、加拿大和美国取得监管上的里程碑,Beyfortus也正向日本、中国等市场冲刺。不过,Beyfortus也得面临后来者的挑战。辉瑞不久前获批的RSV疫苗Abrysvo,在孕妇群体中也有不错的防护表现。mRNA巨头Moderna也在尝试开发相关疫苗,候选产品mRNA-1345涵盖了5岁及以下的RSV暴露和未暴露的儿童。
灼识咨询研究数据显示,包括预防和治疗在内,RSV药物全球整体市场规模将快速增长。其中,针对儿童的RSV药物预计将从2020年的18亿美元增至2030年的117亿美元,将占全球RSV药物市场的91.1%。
2
Vanflyta:可延长3倍CR中位时间
7月20日,FDA批准第一三共的创新药Vanflyta(quizartinib)上市,用于一线治疗FLT3-ITD突变的新诊断AML成人患者。同时,FDA还批准LeukoStrat CDxFLT3突变测定法作为Vanflyta的伴随诊断。
根据新闻稿,Vanflyta是首个获得FDA批准用于AML患者诱导、巩固和维持三个治疗阶段的FLT3抑制剂。
AML是块“硬骨头”已成为业界共识。在过去的几十年间,AML治疗方案从基于阿糖胞苷的化疗到造血干细胞移植迭代,有效延长了患者生存期,但数据仍然称不上理想。不过,随着分子技术发展,更多基因突变、细胞表面标记等被发现,AML研发迎来了越来越多的可能性。
作为一款口服、具选择性的2型FLT3抑制剂,Vanflyta为AML带来了新机制的治疗方式。该药曾获FDA授予的孤儿药资格、突破性疗法认定、快速通道资格和优先审评资格。2019年6月,Vanflyta在日本获批上市,用于治疗携带FLT3-ITD基因变异的R/R AML患者。
不过,由于该药具有潜在的致死风险,FDA对其QT间期延长、尖端扭转性室性心动过速和心脏骤停提出了黑框警告。
此次获批是基于QuANTUM-First的研究结果。试验显示,与安慰剂相比,Vanflyta组患者的死亡风险降低了22%,两组患者的CR率相似,不过,Vanflyta组患者CR的中位持续时间为38.6个月,而安慰剂组仅为12.4个月。
FLT3是一种跨膜受体酪氨酸激酶蛋白,可导致细胞的异常增殖,诱导肿瘤发生,特别是与AML的发生、发展密切相关。研究表明,70%以上的AML患者和ALL患者体内FLT3呈高表达。而FLT3-ITD是最常见的FLT3基因突变,约有25%新确诊的AML病患带有FLT3-ITD突变。
Vanflyta主要与FLT3受体的ATP结合结构域相邻区域中的非活性构象结合发挥抑制效应,具有靶向抑制FLT3-ITD的高效性、特异性及持久性。考虑到AML患者的5年相对生存率目前为30%左右,FLT3-ITD AML患者甚至约20%,更长期的缓解仍是该细分市场重点之一。
在FDA批准Vanflyta之前,已上市的三大FLT3抑制剂,包括Midostaurin、Quizartinib和Gilteritinib。

FLT3结构示意图,图源:药闻窗
而除了FLT3抑制剂,市面上可与标准化疗联用作为一线治疗AML的药物,还有Agios旗下药物IDH1/2抑制剂Idhifa (enasidenib)、Tibsovo(ivosidenib),以及辉瑞研发的Hedgehog抑制剂Daurismo(glasdegib)等。
3
Xdemvy:首个蠕形螨性睑缘炎药物
7月25日,FDA批准Xdemvy(lotilaner滴眼液,0.25%)用于治疗蠕形螨性睑缘炎,该药来自Tarsus Pharmaceuticals,曾被命名为TP-03。据悉,Xdemvy是FDA批准的首个直接靶向疾病根本原因的蠕形螨治疗药物。
蠕形螨性睑缘炎是一种由蠕形螨感染睑缘引起的慢性炎性反应性疾病。该病对睑缘的破坏较大,且容易反复发作,导致脂质分泌减少,泪膜稳定性下降,进而引发干眼。
根据弗若斯特沙利文,全球蠕形螨睑缘炎的患者人数,由2017年的4.47亿人增加至2021年的4.68亿人;中国蠕形螨睑缘炎的患者人数相对稳定,由2017年的5810万人增加至2021年的5880万人,复合增长率为0.3%。
非竞争性γ-氨基丁酸氯离子通道(GABA-Cl)拮抗剂Xdemvy,可选择性抑制寄生虫体内的GABA-Cl通道,从而将其麻痹和杀死。由于其具高度亲脂性,可促进其在螨虫所在睫毛毛囊的油性皮脂中的吸收。医药魔方数据库统计,全球共4款在研GABA-Cl拮抗剂,Xdemvy是进展最快的。

在Saturn-1试验中,Xdemvy组中44%的患者和赋形剂组中7%的患者在第43天达到主要终点。而在次要终点中,接受Xdemvy治疗的患者中有68%取得了螨虫根除(螨虫密度为0只螨虫/睫毛),而赋形剂组的比率为17%;Xdemvy治疗患者的红疹治愈率为19%,赋形剂组比率为7%。
在Saturn-2试验中,Xdemvy组中有55%的患者达到主要终点,而赋形剂组中这一比例只有12%。Xdemvy组和赋形剂的患者分别有50%和14%的螨虫被根除。据报告,Xdemvy治疗的患者中有30%的红疹治愈,赋形剂治疗的患者中有9%的红疹治愈。
值得一提的是,2021年3月,联拓生物与Tarsus达成战略合作协议,获得Xdemvy(TP-03)在大中华区域的独家开发和商业化权益。根据协议条款,Tarsus收取1500万美元的预付款,还有机会获得高达1.85亿美元的开发和商业化里程碑。
目前,联拓生物正在开展一项名为LIBRA的III期临床试验,旨在评估TP-03在中国成人蠕形螨睑缘炎患者中的有效性和安全性。联拓生物预计,将在2023年第四季度公布LIBRA研究的顶线结果。
参考文献:
1、全球首款蠕形螨睑缘炎新药在美申报上市!联拓生物拥有中国权益;医药魔方
2、FDA官网
3、药明康德公众号
4、FDA批准第一三共的AML药物,并附黑框警告;生物药大时代
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..