Carl June被誉为"CAR-T细胞疗法之父"。他是CAR-T细胞疗法的关键推动者和创始人之一,他在该领域的贡献对癌症治疗产生了革命性的影响。近日,Carl June 等在 Nature 发表了题为:CAR T therapy beyond cancer: the evolution of a living drug 的文章。本文回顾了 CAR-T 疗法背后的基本原理、当前CAR-T治疗肿瘤面临的挑战、非癌症疾病的临床前研究概述,以及对相关新兴技术的讨论。概述了 CAR-T 疗法超越癌症的前进之路。

过去十年里,嵌合抗原受体(CAR)-T细胞疗法改变了肿瘤治疗领域的格局,为癌症病人带来了新希望。但其实CAR-T的诞生最早并不是为了应对癌症,而是为了重新定向T细胞使其能够消灭人类免疫缺陷病毒(HIV)。虽然早期的实验结果不尽人意,但是随着研究者的不断尝试,并且在结构上的不断优化(加入共刺激域,图1),使CAR-T在治疗复发难治性的血液肿瘤中展现出传统疗法无可比拟的治疗效果。这些临床实验的成功令人振奋,也持续推动着过继细胞治疗的发展。随着实验的进展,研究者发现其疗效并不局限于肿瘤治疗,同时在治疗自身免疫、慢性感染、心脏纤维化、衰老相关疾病和其他疾病方面,CAR-T也有巨大的潜力(图2)。
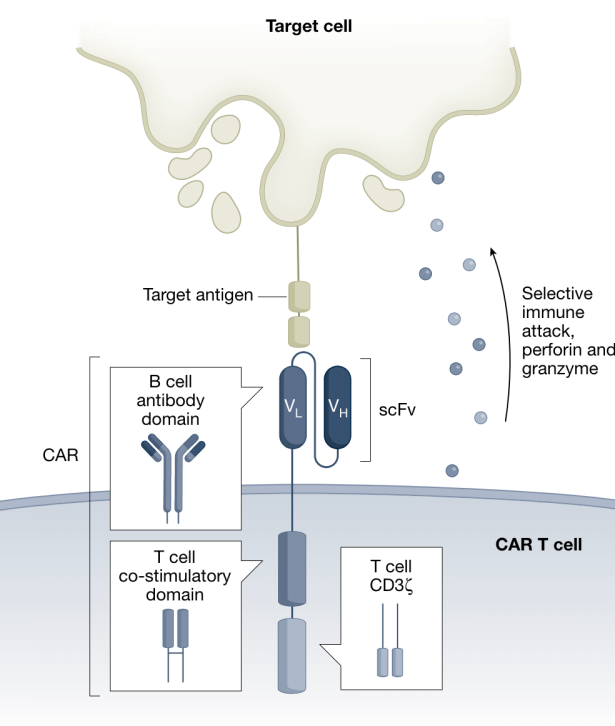
图1. CAR的结构[1]
1. 困境
CAR-T治疗肿瘤的局限性
虽然CAR-T在血液肿瘤领域已经有了多年的研发与临床经验——全世界范围内有超过15000名患者接受过CAR-T治疗,但是CAR-T治疗仍有一些亟待解决的问题。首先是安全性问题,细胞因子释放综合征(CRS)是CAR-T治疗最常见的并发症,它的发生主要是由于短时间CAR-T的大量扩增导致细胞因子大量释放,使患者发烧、低血压甚至器官衰竭或死亡。还有一个很现实的问题,就是价格。CAR-T的治疗属于是患者定制的治疗模式,其生产过程需要专门的设施以及专业的人员,这就是CAR-T治疗在国内100多万一针的原因,极高的定价也让许多患者望而却步。
血液肿瘤尚且如此,而实体瘤则面临更加棘手的问题。首先是缺少像B细胞淋巴瘤类似的特异性靶点(抗原),实体瘤的靶点往往是相较于正常组织过度表达的某些抗原,这可能会导致非肿瘤靶向(on target off tumor)毒性,即CAR-T对非肿瘤组织进行了杀伤,会导致严重的组织毒性甚至死亡。更麻烦的是,相较于血癌,实体肿瘤拥有特殊的微环境(TME),他们有够抵御CAR-T浸润的天然物理屏障,并且肿瘤内部的酸性环境以及特殊的细胞因子会产生免疫抑制。正是这些难题使得针对实体瘤的CAR-T临床试验结果往往令人失望。而研究者们也在积极的开发新的方法力求克服这些问题,例如直接在肿瘤内部注射CAR-T细胞,或者使用针对TME的溶瘤病毒破坏TME环境促使CAR-T浸润等等。

图2. CAR-T治疗的应用[1]
2.新的战线
CAR-T在非肿瘤领域的应用
尽管在实体瘤方面的应用仍然不够成熟,但是多年的CAR-T临床试验的经验告诉我们——消除特定的细胞群体能够有治疗作用,并且我们有能力专门针对这样的群体设计CAR-T。这让研究者不再局限于肿瘤治疗领域,开始探索由于特殊细胞群体的病变导致的其他难治性疾病。从最新公布的临床实验结果来看,CAR-T的确能够用于治疗某些自身免疫性疾病、慢性感染、心力衰竭和其他慢性疾病。
其实回顾来看,治疗非癌疾病本身就比治疗实体瘤有许多优势。首先,肿瘤细胞的负荷通常非常大,需要输注大量的CAR-T细胞,这会增加CRS风险与脱靶肿瘤毒性事件的比例,而在其他疾病中,需要清除的靶细胞数量往往较少。其次,癌症的治疗必须100%清除癌细胞,不然还是会有复发的可能,其他疾病则清除部分的病理细胞也可能有治疗作用。另外,肿瘤会在免疫压力下持续突变,直到完成抗原逃逸(即目标抗原的丢失),其他疾病则几乎不具备发生抗原逃逸的条件。最后,也是最关键的是,实体瘤的TME,其产生的天然屏障以及免疫抑制环境导致CAR-T难以有所作为,其他疾病并没有形成这样的微环境,使得CAR-T容易清除病变细胞(图3)。种种条件造就了CAR-T在非癌疾病领域的飞速进展,现在让我们来具体看一下它的神勇表现吧!
2.1 自身免疫炎症疾病
SLE(系统性红斑狼疮)是一种可能危及自身生命的免疫性疾病,2021年到2022年,某研究小组先后注入anti-CD19(B细胞的特异性抗原)的CAR-T进入到6名患者体内,所有患者体内 CAR-T 细胞均出现扩增,B 细胞快速被消灭,SLE 症状得到缓解,终末器官损伤标志物明显下降。所有患者均停止了免疫抑制药物治疗,处于无药物缓解状态。短期随访显示,在 CAR-T 细胞输注几个月后,幼稚 B 细胞重新出现,并且没有出现疾病复发的征兆。CAR-T 细胞的给药耐受性良好,仅出现轻度 CRS 病例,这与较低的靶细胞负荷可能减轻 CRS 的严重程度的观点一致。
Anti-CD19 CAR-T 细胞同样被用于抗合成酶综合征导致的炎症性肌病患者。为病人进行CAR-T细胞输注后,患者肌痛加剧,血清肌酐激酶升高,输注180天后,其身体机能显著改善,股四头肌和腿筋肌炎逐渐消退,肌酸酐激酶以及其他临床指标也逐渐正常。
其实,只要是由于B细胞或者浆细胞的自身免疫与炎症疾病都可能是CAR-T治疗的潜在适应症,包括中性粒细胞胞浆抗体相关性血管炎、类风湿性关节炎、肌炎、多发性硬化症、寻常型天疱疮、免疫性血小板减少症、重症肌无力和视神经脊髓炎等等。并且,只要是针对B细胞或者浆细胞杀伤的靶点(BCMA, GPRC5D, CD20 and CD22)都有可能成为潜在的CAR-T治疗靶点。
消除炎症细胞的另一种方法是将调节性 T (Treg) 细胞重定向到靶组织。这些细胞没有细胞毒性,但提供旁分泌信号来抑制炎症和自身免疫反应。将CAR转染到Treg细胞中可以提高特异性并降低全系统免疫抑制的风险。
目前,各种自身免疫疾病的CAR-T临床试验及临床前研究都证明该类疾病可能是CAR-T疗法最有前景的领域之一。
2.2 脏器纤维化
心脏纤维化是急性损伤、慢性疾病或衰老导致的,它会导致近期的发病率和长期的死亡率增加。目前,针对心脏纤维化的治疗方法有限。最近的临床前研究表明,CAR-T细胞可以针对纤维化并在高血压损伤后恢复心脏功能。研究人员在心肌病患者的心脏中鉴定了纤维母细胞特异性抗原,发现纤维母细胞活化蛋白(FAP)是表达最高的靶点。注入anti-FAP CAR-T细胞可以在心脏损伤后解决纤维化问题,并改善心脏功能。使用 CAR-T 细胞靶向病理性纤维化的意义不仅仅限于心脏病。细胞外基质的沉积和纤维化在多种疾病中都是病理性的。肝脏疾病、慢性肾脏疾病、肺部疾病、骨骼肌疾病和许多其他情况可能适合使用抗纤维化 CAR-T细胞进行治疗。
2.3 衰老
多种应激源可导致细胞经历不可逆的增殖停滞,称为细胞衰老。研究表明,去除这些细胞对各种慢性疾病模型有益。靶向衰老细胞的细胞内通路的小分子药物似乎很有前途,但其药效、特异性和副作用的问题限制了它的发展。CAR-T因其固有的特异性和效力而被研究者认为是极具竞争力的新型疗法。衰老细胞在生命早期就被免疫系统生理清除,利用CAR增强免疫细胞并延长这一过程可能使机体获得很大收益。
最新的研究表明,CAR-T 细胞可以清除癌症和肝病小鼠的衰老细胞。PLAUR 编码尿激酶型纤溶酶原激活剂受体 (uPAR),被认为是一种潜在的血清抗原,并且在重要组织中表达水平相对较低。Anti-uPAR CAR-T 能成功消除癌基因诱导的肝脏衰老细胞、肿瘤治疗诱导的肺部衰老细胞、药物诱导的肝纤维化和饮食诱导的非酒精性脂肪性肝炎衰老细胞。由于衰老细胞具有异质性,因此鉴定衰老抗原既困难又重要。其他可用于生成衰老 CAR-T 细胞的靶标包括 NKG2D 配体、MICA、MICB 和 ULBP1-5,它们在多种衰老细胞中表达,另一个潜在靶点是糖蛋白非转移性黑色素瘤蛋白 B (GPNMB),针对这一靶点的免疫治疗可以清除衰老细胞,改善代谢参数,减少动脉粥样硬化斑块并延长雄性早衰小鼠的寿命。因此,GPNMB 可能是 CAR-T 疗法的合适衰老靶点。
2.4 感染
靶向非机体的抗原将大大降低off tumor的毒性风险。正如前所述,最早CAR-T是为了治疗HIV感染的病人的。病毒感染宿主细胞后,将在细胞表面显示特异性的抗原,针对这些抗原设计的CAR-T将具有清除感染的潜力。随着CAR-T结构的优化,基于二代结构的CAR-T也被应用于HIV的治疗,相关的临床实验也在积极的开展。还有利用真菌模式识别受体开发了的 CAR-T,以识别真菌细胞壁中的碳水化合物抗原。这种方法在体外和小鼠模型中具有抗真菌特性。同样,最近的一项研究测试了 CAR-T 细胞对抗侵袭性肺曲霉病的功效,研究表明该CAR-T细胞在体外和侵袭性肺曲霉病小鼠模型中均显示出抗真菌特性。
虽然CAR-T在慢性感染方面有着发展的空间,但是对于急性感染,需要紧急反应,当前的CAR-T离体生产过程无法满足这一需求。
2.5 移植物抗宿主病(GvHD)
CAR-T细胞疗法可以通过识别和消灭引发GvHD的免疫细胞来减轻炎症反应。有的研究团队正在尝试设计anti-OX40 CAR-T(OX40是急性 GvHD 中致病性 T 细胞中上调的一种蛋白质),以针对GvHD相关的免疫细胞进行清除。
以上总结了CAR-T在非癌症疾病领域的临床与临床前研究,这些结果都提示这种治疗方式确实能够通过清除某群特殊的病变细胞,对患者进行治疗。并且相较于小分子药物与单克隆抗体有更彻底、更持久的治疗效果。这些结果让研究者相信CAR-T会开拓出超越肿瘤治疗的新战场。

图3. CAR-T疗法在癌症与其他疾病中的区别[1]
3. 新的曙光
新技术在CAR-T上的应用
随着基因编辑技术与mRNA疫苗技术的飞速进展,以及研究人员的不断探索,将CAR-T疗法积极的与各种新兴技术进行融合,力求让其走出现在的困境。
3.1 mRNA的靶向递送技术
FDA 批准的针对 2019 年冠状病毒病的疫苗证明了 mRNA 疗法的广泛功效。尽管 FDA 批准的疗法是非靶向的,但目前正在进行多项使用靶向脂质纳米颗粒 (tLNP) 将 mRNA 特异性递送至选定细胞的临床试验。这种技术主要是通过将靶向抗体结合到 LNP 表面来实现的。
已经有多个研究小组证明可以将修饰后的 mRNA CAR在体内递送至 T 细胞。在白血病和前列腺癌小鼠模型中, mRNA 工程化 CAR-T 细胞的表现与逆转录病毒工程化 CAR-T 细胞类似,可以控制肿瘤并提高生存率。另一项研究表明,tLNP 可以将anti-FAP CAR mRNA 传递至小鼠的 T 细胞,从而在心力衰竭模型中产生 CAR的表达并成功减少纤维化最终改善心脏功能,这与之前逆转录病毒转导的 anti-FAP CAR-T 研究结果相似。因此,仅通过单次注射tLNP包裹的mRNA就可以在体内产生具有功能性和治疗水平的CAR-T细胞。
与目前临床使用的方法相比,tLNP 介导的 CAR mRNA 递送具有明显的优势。首先是成本。目前,CAR-T疗法需要昂贵的离体制造过程(图4)。在患者体内生成 CAR-T 细胞将降低制造成本并实现快速扩展。其次是安全性。目前的疗法需要在 CAR-T 细胞输注之前进行淋巴细胞清除,以优化植入。这一过程会增加由于 CAR-T 急性扩增而导致 CRS 风险,以及由于基因毒性而导致继发性恶性肿瘤的风险。体内生成可以有效避免这些问题,提高安全性。
最重要的一个潜在优势是,mRNA 递送的方式使 T 细胞表达 CAR 具有瞬时性,在mRNA 降解后会丢失(图 4)。目前的 CAR-T 是稳定表达 CAR,并且可以在某些患者体内持续数十年。当然,就癌症而言,持久性是一个优点,但对于不希望或不必要持续清除的疾病来说,可能是一种负担。例如,一次性去除一部分心脏纤维化可能足以改善心肌收缩力,而长期抑制纤维化可能会抑制其他重要过程,例如纤维化介导的伤口修复。
当然,mRNA CAR-T的在体内的安全性仍需要研究者们进一步的探究。
3.2 病毒载体体内递送技术
除了mRNA的靶向递送之外,也可以考虑用病毒载体实现CAR的体内递送,尽管可能仍然比mRNA递送更昂贵,但是相较于传统疗法,仍然成本可控。但是该方法有脱靶的风险,可能会导致将CAR递送并转染到其他细胞基因组中,如果进入到生殖细胞中则可能造成种系传播的严重后果。该方法相较于mRNA的优势在于,能够产生持续存在的CAR-T细胞,对于癌症这种需要持续CAR-T细胞的疾病更具应用前景。
3.3 制备同种异体CAR-T
同种异体CAR-T或者叫通用型CAR-T,这种方法依然依赖于离体制备,但是不是用的患者细胞,而是来自于健康供体或者诱导多能干细胞。某些癌症病人的免疫系统低下,无法从自体获得足够的T细胞,通过这种方式可以使潜在CAR-T治疗受益人群接受治疗。尽管同种异体 CAR-T 细胞具有潜在的好处,如降低成本、简化制造等,但制备过程也更为复杂,需要对同种异体 T 细胞进行基因改变,以防止 GvHD的发生。
除了上述方法,文中还列举了一些研究者做出的尝试,例如使用CRISPR编辑CAR-T,能够提高其功能与持久性。还有研究者通过引入“合成细胞电路”的概念来设计CAR-T,举例来说就是“AND电路”需要两个独立的受体分别结合它们的抗原才能激活CAR-T细胞,此外,还包括又抑制信号介导的“NOT电路”以及与Notch信号通路介导的“IF-THEN电路”。这些策略可以提高过继细胞的效力、降低毒性或调节 CAR 表达。另外一个方向是工程化其他免疫细胞。在自然杀伤细胞、巨噬细胞、树突状细胞、B 细胞和 γδ T 细胞中表达的 CAR 已显示出一定的临床前潜力。与 αβ T 细胞(即传统CAR-T工程化的T细胞)相比,改造这些细胞可能会降低 GvHD 和 CRS 的风险。
所有这些研究者的尝试都为CAR-T摆脱现在的困境带来了新的曙光。
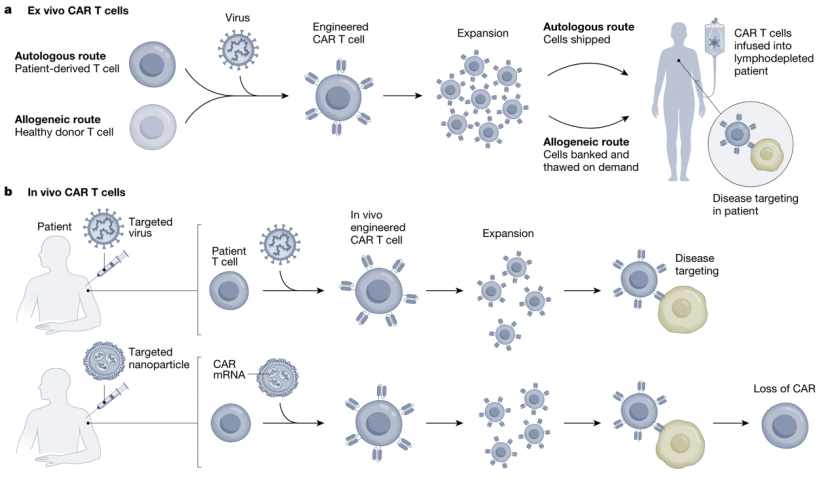
图4. 传统离体制备CAR-T与新兴体内制备CAR-T的区别[1]
4. 新的征程
临床转化之路
CAR-T在不同疾病领域的应用,以及与新兴技术融合的成果已经在临床前或早期临床阶段得到了验证,但是要成功完成临床转化,成为一款稳定的药物,还有很长的路要走。
首先,找到合适的抗原是最关键的问题。目前常用的方法是通过转录组或者其他组学数据找到靶组织或靶细胞的特异上调的抗原。找到可靶的抗原是第一步,接着需要关心的是安全性问题。CRS 是 CAR-T 疗法临床上最常遇见的毒性问题。临床前应反复确认在新疾病的应用中是否出现 CRS 样症状。除了CRS,还需要关注的是CAR-T对生理细胞的清除可能带来的副作用。消除健康细胞亚群(例如 SLE 中的 B 细胞)具有治疗作用。然而,清除这些细胞的长期影响尚不清楚。随着这些试验的扩大,我们将了解清除健康细胞是否存在长期并发症。
除此之外,CAR-T的临床治疗还有许多悬而未决的问题。① CAR-T的治疗指数,使用治疗指数来平衡CAR-T治疗的最佳效果与安全性,从而确定适当的给药剂量。② 患者给药的最佳时间,可能需要根据每种疾病的发病机制而调整相应的给药时间。③ 确定是否存在治疗终止时间点,继续治疗可能不再有帮助甚至可能有害。④ 对于具有再生能力的组织,应确定消除病理细胞是否可以使健康组织恢复活力。⑤ 还应该探索 CAR-T 细胞在非癌组织中的运输情况。局部递送的 CAR-T 细胞可能会带来更好的结果并减少潜在的毒性。
尽管还有上述问题等待我们回答,但是我们前进的脚步从来没有停下。随着越来越多的 CAR-T 产品被应用于实体癌治疗,随之产生的长期随访数据也日益丰富,通过回顾这十年的研究,我们能够从中汲取到很多经验。CAR-T细胞在血液癌症中的成功应用为实体瘤治疗奠定了基础,而CAR-T在肿瘤学的成果将为其他疾病的转化应用提供关键的经验。
5. 结语
虽然CAR-T疗法最初是为治疗HIV而开发的,但由于其在血液系统恶性肿瘤治疗中的应用,它已经受到广泛关注。如今,CAR-T疗法准备用于治疗更广泛的疾病范围。CAR设计和传递方面的新兴技术进一步增强了这种潜力。全球各地的实验室研究结果都在证明,CAR-T疗法在治疗自身免疫性疾病、慢性感染、纤维化和衰老方面有着传统药物无可比拟的能量。一颗指引人类健康终老的启明星正在冉冉升起。
参考文献:
1. Baker DJ, Arany Z, Baur JA, Epstein JA, June CH. CAR T therapy beyond cancer: the evolution of a living drug. Nature. Jul 2023;619(7971):707-715. doi:10.1038/s41586-023-06243-w
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..