在7月21日举办的“2023中国医药创新政策论坛”上,中国医药创新促进会执行会长宋瑞霖分享了“推动中国医药创新高质量发展的思考”的主题报告。他在报告中聚焦现阶段创新同质化的问题,从基础研究、临床研究与转化等完善产业链领域,深度分析了制约原始创新的关键因素,并提出相应的政策建议。

励精图治的政策之路从未停歇,“第二方阵”毋庸置疑
医药行业最大的特点在于政策敏感性,国家医保局关于创新药谈判准入的续约和竞价规则征求意见稿引发资本市场上涨正是其生动体现。宋瑞霖会长认为,好的政策能够体现在产业价值上。
他指出我国是全球医药政策领域最活跃的国家,中国紧紧围绕“推进健康中国建设”的重大理念,励精图治的政策之路从未停歇。从2015年到2022年我们经历了药品的审评制度改革,经历了《药品管理法》的修改,《疫苗管理法》的制定,以及《专利法》的修改。
政策的改善必然会带来改革的成果。我国创新稳步前行,历年首次IND、首次NDA、首次获批上市的国产创新药数量不断提升。尤为重要的是,我国医药创新研发标准已与国际全面接轨,ICH指导原则落地转化率在实践中已实现了100%。在这一过程中,中国深度参与了ICH规则制定,为世界医药创新做出了应有贡献,也为中国医药创新未来奠定了基础。在IFPMA与ICH秘书处所组成的国际专家组成员中,由中国药促会推荐的中国专家达到了总数的53%。中国医药创新研发对全球的贡献已经居于“第二梯队”前列,无可争议。
直面挑战:产业创新与临床需求脱节,原始创新缺失
“虽然中国稳居‘第二方阵’前列,但和美国相比有明显的差距。中国医药创新越是前行的速度快,我们越发现面临的挑战多。”宋瑞霖会长直言。
报告指出,基础研究能力仍需提升。从研究机构的世界排名来看,在2021年Nature index指数评估TOP100生命科学机构和医学研究机构中,中国机构的数量与2015年相比幅度提升,尤其是医学研究机构与2015年相比从1家增长至22家。这22家中国医学研究机构地域分布在上海9家、广州与杭州各3家,成都与武汉各2家、北京合肥南京各1家。
基础研究的成果转化亟需加强。我国专利申请数量为全球第一大国,但是相当一部分没有得到国际专利授权,高校及科研院所的专利转化率常年处于低位,医药专利授权转化能力明显不足。根据国家知识产权局2021年关于制约专利转移转化因素的调查报告,有58.3%的专利不能满足市场化需求,更有54.8%的专利申请本身不以转移转化为目的。
宋瑞霖会长解析,专利只能证明是否原创,与药好不好无关,但如果专利申请本身只是为了申请职称却从未考虑是否可以转化,意味着源头创新的缺失。临床需求与产业创新发展明显脱节,新药研发都在“盯着药”而非“盯着病”,必然导致创新同质化的现象严重。若要摆脱这一困境,医药的创新研发就需要从“以临床价值为导向”向“以临床需求为源头”转化。

![]()
宋瑞霖:我国缺少临床医学科学家,是政策导向出了问题
基础研究和技术转化已经成为制约产业创新发展的瓶颈。如何将基础研究和转化医学的研发落到实处、畅通创新产业链,不仅仅是产业界,也是医学界认真思考的问题。
从完善产业链政策角度来看,创新链条源头端供给不足,制约了科研成果发挥创新源头的作用。临床医学转化是基础科学实现试验转化与产业化的关键环节,更是医药创新的重要来源。由申办方发起的注册性试验(IST)与由研究者发起的临床研究(IIT)相辅相成,共同扩展药物研究的广度和深度。当前我国新药临床试验主要是由药企发起,而IIT作为全球医疗中广泛存在的重要研究形式,在我国开展临床试验用于注册的数量少之又少。我国目前医疗机构主要承担临床治疗、临床试验的职责,对IIT研究的定位仅局限于已上市药物的适应症探索,转化医学没有在新药研发的整体链条中发挥作用。
除了不断完善创新产业链,创新药的市场政策仍需加强。宋瑞霖会长强调,合理的创新回报是市场发展的前提,药物创新的目的是能够应用于临床实现价值。实施“双通道”政策是因为创新药在医疗机构的准入障碍。根据RDPAC《国谈药品落地情况分析》,2017-2021年谈判纳入医保的49种抗肿瘤药在三级医院配备率平均为16.8%。

他同时强调,罕见病患者用药可及性是不可回避的问题。目前谈判药品费用支出对医保基金的影响甚微,创新药的市场份额远不及辅助用药的份额,新药价格与合理用药问题亟待进一步解决,政策调整的空间巨大。
抓短板,找漏洞,激活创新之“源”
今年5月,习近平总书记强调生物医药产业是关系国计民生和国家安全的战略性新兴产业,这是继国务院确定七大战略性新兴产业之后,习近平总书记对生物医药产业战略性地位的又一次明确定位。基于此,关于生物医药产业的政策研究及发展规划要主动对接这一战略需求。
行业政策的完善需要回归至党中央国务院对生物医药的战略定位,医药行业政策完善更需前瞻性的目光。宋瑞霖会长认为“战略性决定我们必须要登高望远,我们一定要能够考虑到未来,当我们填补空白之后,我们吃饱肚子之后,我们要想明天、后天、未来怎么过。”关于激发原始创新动力和活力,促进医药创新高质量长期发展,他提出以下几点思考和建议:
一是建立基础研究成果转化和市场回报之间的双循环。7月11日习近平总书记主持召开的中央全面深化改革委员会第二次会议强调开展高等学校、科研院所薪酬制度改革试点。建议政策上放开研究成果转化方式,允许基础研究者个人与企业之间建立市场化、商业化框架下的合作机制,以激发个人和团队的积极性,促进基础药物研究的深度发展。在全球角度下新兴生物制药企业始终在医药研发中占据主体地位,真正的创新往往是来自该类企业,即“Small company big thinking”。
二是探索放开IIT临床研究的限制,推动源头创新能力提升。基础临床研究是原始创新的核心点和起点。我们需要在风险与发展之间进行平衡,对PI进行严格的资质管理,确保其足以控制IIT临床试验的风险;同时对IIT临床试验机构的资质严格管理、逐步放开,联合形成“产、学、研、用”的创新体系。
以CAR-T领域为例,我国对CAR-T的双轨制监管,导致CAR-T临床研究突破了传统IIT仅针对已上市产品的限定,多数企业通过与医院合作进行IIT收集数据并对细胞治疗产品进行早期确证。进而造就中国在CAR-T领域的世界领先地位,目前全球获批CAR-T产品有8个,其中4个为中国企业研发。
三是需要打破信息孤岛,强化医研企的合作。以生物样本库为例,目前我国众多的生物样本均封闭在各个医院的冷库里,没有实现信息、数据的共享。加强合作、数据互通是医药创新进一步发展的必要条件。
四是尊重创新药价值,不断完善高价值创新药保障体系,建立以临床价值为导向的药品全生命周期准入体系。高价格的创新药无法进入医保时,受影响最大的为弱势群体,这与医保“保基本”的原则相违背。建议通过风险共担的形式搭建创新药的合理回报模型,同时也为商业保险留出发展空间;针对多数创新药通过加速批准上市、临床价值尚不明确的情况,设立动态评估机制,使其能够基于临床价值获得合理收益。
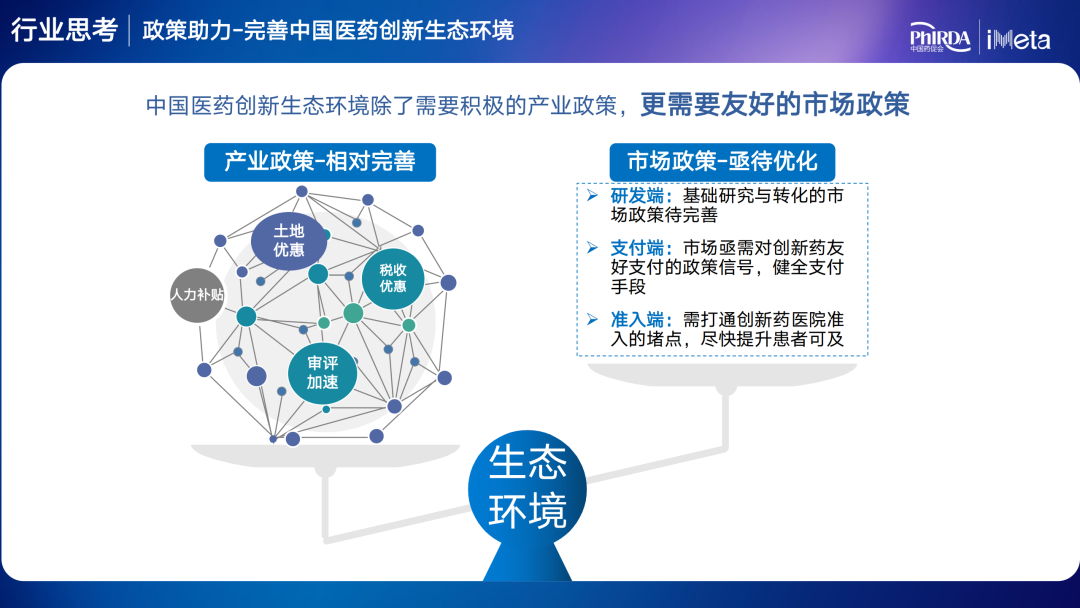
最后,他认为中国医药创新生态环境除了需要积极的产业政策,更需要友好的市场政策。只有不断完善药物创新的政策生态环境,才能有效带动产业投资和发展,激发原始创新动力和活力,进而推动中国医药创新高质量发展。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..