2010版GMP要求为依据,探讨了非最终灭菌产品分装车间的设计要点,并以非最终灭菌小容量水针注射剂产品和冻干粉针注射剂产品为例,对不同形式分装车间的平面布局进行了对比分析。
Part
1
引言
无菌药品按生产工艺的不同可分为最终灭菌产品和非最终灭菌产品,后者由于半成品不能采用任何形式的最终灭菌工艺去除微生物,所以需要采用无菌生产工艺进行生产。
常规非最终灭菌小容量注射剂分装车间流程如下:原辅料分别经过浓配、过滤、稀配、除菌过滤等工序,等待分装;检验合格的包装材料(西林瓶或安瓿瓶)经理瓶、洗瓶、烘瓶(灭菌)传至灌装间,灌装操作在A级层流保护下进行;对于冻干粉针产品,灌装完成后先进行半加塞,再冷冻干燥,产品在A级层流下进出冻干机,以保证产品质量,冻干后进行全压塞轧盖,轧盖工序完成后,即完成整个分装过程。对于小容量水针注射剂产品,灌装完成后无需冻干,直接进行轧盖或封口操作,完成整个分装过程。
灌装工序是分装车间的核心工序,目前多采用洗、烘、灌联动线进行洗瓶,经隧道烘箱灭菌后,在A级层流下自动灌装,整个生产传输过程均在密闭环境下进行,以减少污染保证产品质量。分装车间是诸多制药企业重要的生产车间之一,科学、合理的车间设计是避免出现生产质量风险的基本前提,是生产出合格产品的重要保障。
Part
2
2010版GMP对非最终灭菌产品生产环境的相关要求
2010版GMP对非最终灭菌产品的生产环境洁净度级别要求如下:
(1)B级背景下的A级:处于未完全密封状态下产品的操作和转运,如产品灌装(或灌封)、分装、压塞、轧盖等;灌装前无法除菌过滤的药液或产品的配制;直接接触药品的包装材料、器具灭菌后的装配以及处于未完全密封状态下的转运和存放;无菌原料药的粉碎、过筛、混合、分装。
(2)B级:处于未完全密封状态下的产品置于完全密封容器内的转运;直接接触药品的包装材料、器具灭菌后处于密闭容器内的转运和存放。
(3)C级:灌装前可除菌过滤的药液或产品的配制;产品的过滤。
(4)D级:直接接触药品的包装材料、器具的最终清洗、装配或包装、灭菌。
在非最终灭菌生产工艺中,可进行除菌过滤的液体产品通常经过无菌过滤以去除微生物,包装材料等经过灭菌后分别进行灌装、封口或半加塞。对于非最终灭菌产品,由于产品分装后不再做进一步灭菌处理,因此,必须对整个生产过程及其操作环境条件进行严格控制,以保证产品不被微生物污染。
Part
3
非最终灭菌产品分装车间的工艺布局设计要点
3.1
无菌生产核心区的设计
非最终灭菌小容量注射剂分装车间的核心区主要包括:产品灌装区域、产品或容器在无菌区内暴露的区域、灭菌后容器的传出、组装区域等,对核心区的设计应注意以下方面:
3.1.1 对污染源的控制
分装车间生产核心区的污染源主要来自工艺设备、进入无菌区的器具、人员及其操作过程等,污染源的主要类型分为尘埃粒子污染及微生物污染。人员作为最大污染源之一,需经穿无菌服、气锁后进入无菌环境;核心区域宜单独设置回更,使人员进、出通道分开;充分考虑人员生产、清洁方式和日常维护等因素,进行合适的空间设计,同时也要考虑对操作人员及环境的保护;设置门禁系统等措施,限制非灌装区人员进、出,在硬件上保证对核心生产区的污染风险的控制。
3.1.2 对气流方向、压差的控制
2010版GMP要求,无菌生产核心区的空气洁净度等级为A级,背景为B级,A级单向流的空气速度必须在0.36~0.54 m/s范围内。良好的气流方向有助于满足环境的温湿度要求和洁净度要求,保证有效的净化能力。由于灌装区域送、回风风量大,设计时应留有足够的回风面积,合理布置送风口、回风口位置。洁净区内相同洁净度级别的不同功能房间之间应保持适当的压差梯度,对相邻洁净房间进行压差控制,以保证合理的气流组织,保证其无菌生产环境。
3.2
轧盖操作区的设计
传统轧盖操作通常会产生铝屑及一些非活性金属颗粒,可能带来污染产品及环境的风险,轧盖区的设计应保证轧盖过程不会对环境及产品造成污染,一是通过改进工艺设备减少风险,二是对轧盖区的设计加以优化。
2010版GMP规定,轧盖应在B级背景下的A级环境下进行;根据已压塞产品的密封性、轧盖设备的设计、铝盖的特性等因素,轧盖操作可选择在C级或D级背景下的A级送风环境中进行。
按照要求,轧盖应作为无菌工艺使用无菌铝盖,即轧盖操作在B+A环境下进行,保证轧盖前空气的无菌性;或作为洁净工艺在无菌区域外进行,并同时保证西林瓶从灌装至轧盖全程处于A级空气保护中,降低污染风险。
除此之外,还需注意如下几点:轧盖操作区与灌装操作区应分开,设置单独的轧盖操作室;轧盖操作区宜设置独立的人员进出通道;轧盖操作区应采用独立排风装置,相对负压,确保轧盖操作不会对洁净区其他区域产生不利影响。
3.3
密闭操作系统的采用
由于手动操作会造成许多风险和不确定性,采用洗灌封设备、限制进出隔离系统及隔离操作器实现密闭自动化的生产已成为一种发展趋势。2010版GMP提出,高污染风险的操作宜在隔离操作器中完成。借助隔离屏障系统,将操作人员和产品分隔开来,一方面提高产品生产过程的无菌性保证,另一方面实现对操作人员的保护。
冻干半成品的转移宜考虑采用自动装载进、卸料系统,该系统通常分为固定式、移动式和混合式3种方式,采用该系统可使核心区全部实现自动化操作,减少A级区内操作人员的干预,降低药品受到污染的概率,更好地保证无菌要求。
3.4
其他方面的设计
分装区作为高风险区及耗能较大的生产区,在满足生产操作及日常维护的前提下,尽量将B级区、A级区最小化;配液罐尽量靠近灌装设备,使物料管线最短;合理设置人员更衣路径,满足规范要求,不宜过于复杂;合理设计物流通道,防止产品/物料交叉;单独设置废弃物出口,防止干净物料与废气物料交叉。
Part
4
非最终灭菌产品分装车间布局模式的对比应用分析
4.1
U字型布局
冻干粉针产品分装车间主要由洗烘、灌装、冻干、轧盖4个生产单元构成,各生产单元洁净级别各不相同,每个生产区相对独立,将各生产单元按工艺流程布置成U字型,如图1所示,以灌装和冻干为中心,灌装冻干室布置在车间的物料廊侧,便于大设备安装和参观。灌装冻干室、灭后间等区域设置在车间中心位置,符合GMP对洁净分区位置的要求。
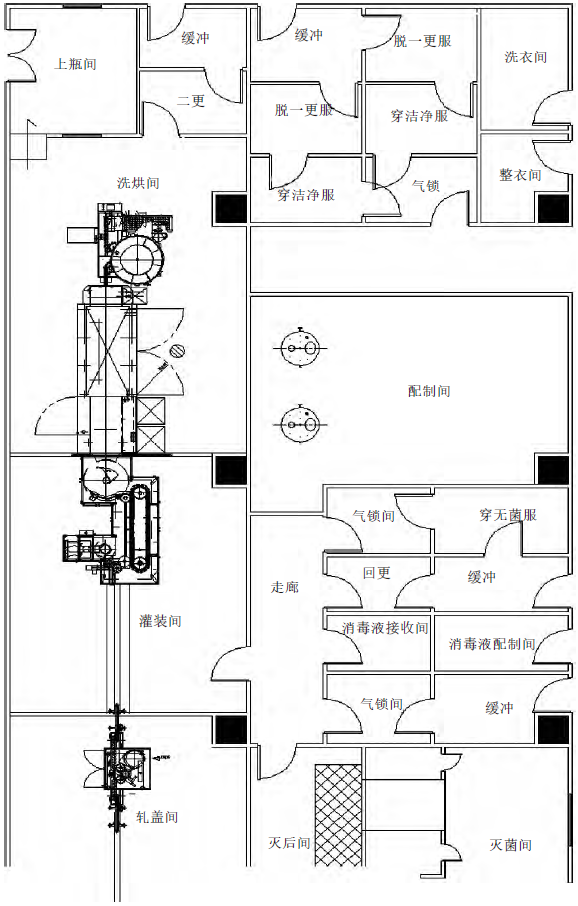
图1 冻干粉针车间U字型布局示意图
冻干车间U字型布局方式越来越普遍,这种布局的优点:(1)洗、烘、灌设备呈L型布置,一是相对减少洁净区面积,二是便于设备检修,设备检修时不用进入高级别洁净区,有效降低了污染风险;(2)可以更好满足人员对于先进、自动化生产设备的参观需求;(3)适合模块化设计,一个模块即一个独立冻干车间,适合多品种产品生产,根据产能需求在一个厂房内复制多个生产模块;(4)主人流、主物流走廊分开设置,主人流从南侧进、出,主物流从北侧进、出,避免人、物交叉。
4.2
I字型布局模式
4.2.1 冻干粉针车间I字型布局
冻干车间I字型布局如图2所示,这种布局模式将整条生产线拉长,一定程度增大了洁净区的使用面积;物流流向分南北两侧进、出,人员流向主要从西侧进、出,人、物流交叉可以避免;整个模块呈不规则形状,浪费生产面积,不利于同层进行多个模块复制。
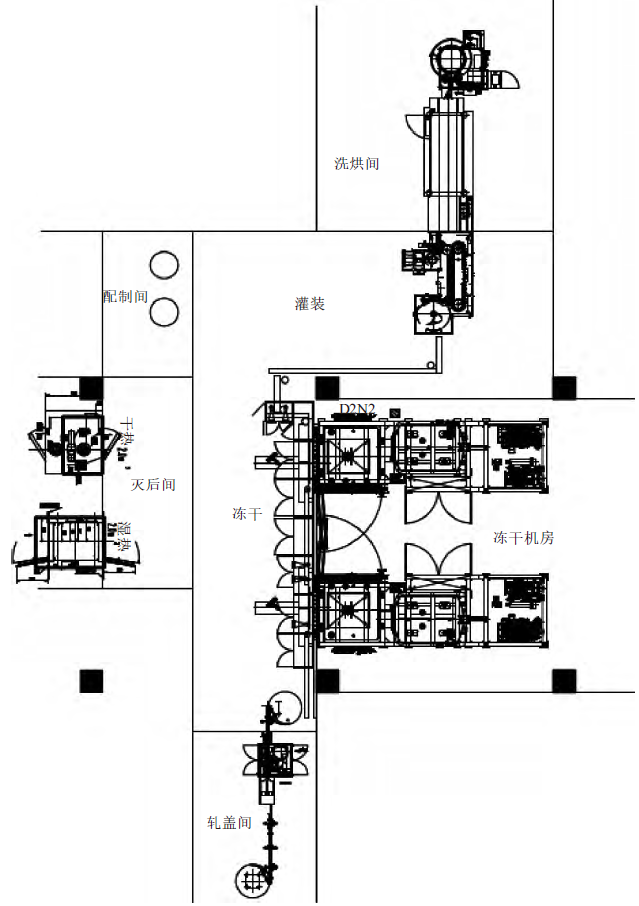
图2 冻干粉针车间I 字型布局示意图
4.2.2 水针车间I字型布局
相比而言,小容量水针注射剂分装车间更适合这种布局方式,如图3所示,I字型模式布局紧凑,节省空间,最大限度减少洁净区面积,节约车间运行成本;人员入口集中在北侧,物料走廊设置在西侧,内包材从西北侧入,产品从西南侧出,整体人、物无交叉;洗、烘、灌联动设备呈直线型,房间靠近走廊,便于参观;此布局适合同层内布置2个独立生产模块。
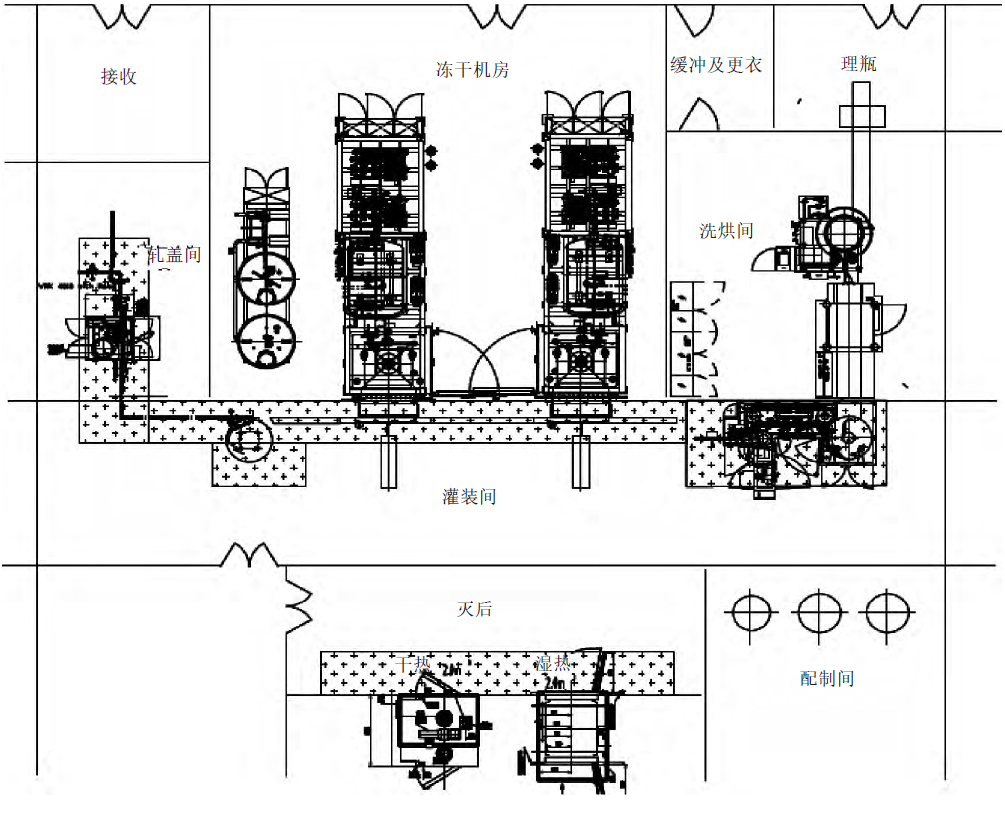
图3 水针车间I 字型布局示意图
Part
5
结语
非最终灭菌产品对无菌生产工艺、环境控制的无菌保证水平要求很高,分装作为高风险操作,对分装车间的设计应严格按照规范要求进行,最大限度降低产品污染风险。本文结合以往项目设计经验,以2010版GMP要求为依据,对非最终灭菌产品分装车间的设计发表了一些观点,与大家探讨。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..