同处寒冬之际,相对于License in的凄凉凋零,中国创新药的License out(授权许可)交易却让人眼前一亮。从趋势上来看,License out交易金额和数量都保持了持续攀升的态势;从单笔交易来说,也不乏打破中国创新药海外授权纪录的事件,可谓呈现了一番别样风采。
根据医药魔方的最新数据,截至2023年6月,国产创新药出让国外权益(License out)的交易合作已达23项,接近去年整年的交易数量(27项)。当然,上半年交易总金额尚不能与2022年的全年数据相媲美,但恰好也与时间相对应(124.0亿美元 vs 248.2亿美元)。
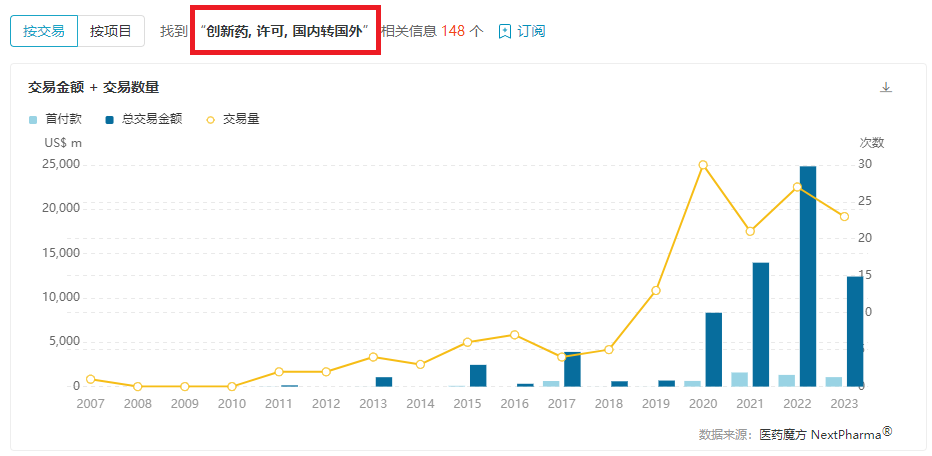
不过,值得关注的是,License out首付款金额已超10亿美元,而2022年全年的总额也才13.1亿美元。面对资本寒冬,中国创新药企能够实实在在地收到首付款,对于挽救企业生存便显得至关重要,甚至比潜在的总金额更具价值。
License out的交易表现不免令人好奇,究竟什么样的创新产品才能够吸引国外企业的浓厚兴趣,并给予它们巨大的价值认可?我们不妨一探其中奥秘。
根据医药魔方数据,剔除无交易金额的授权合作以及其他特殊情况,基于首付款和交易总金额对代表性License out药物进行汇总分析,以期发现在全球资本寒冬的艰难环境中,哪些特征的创新药可以敲开国际License out大门。
国产创新药License out代表性药物
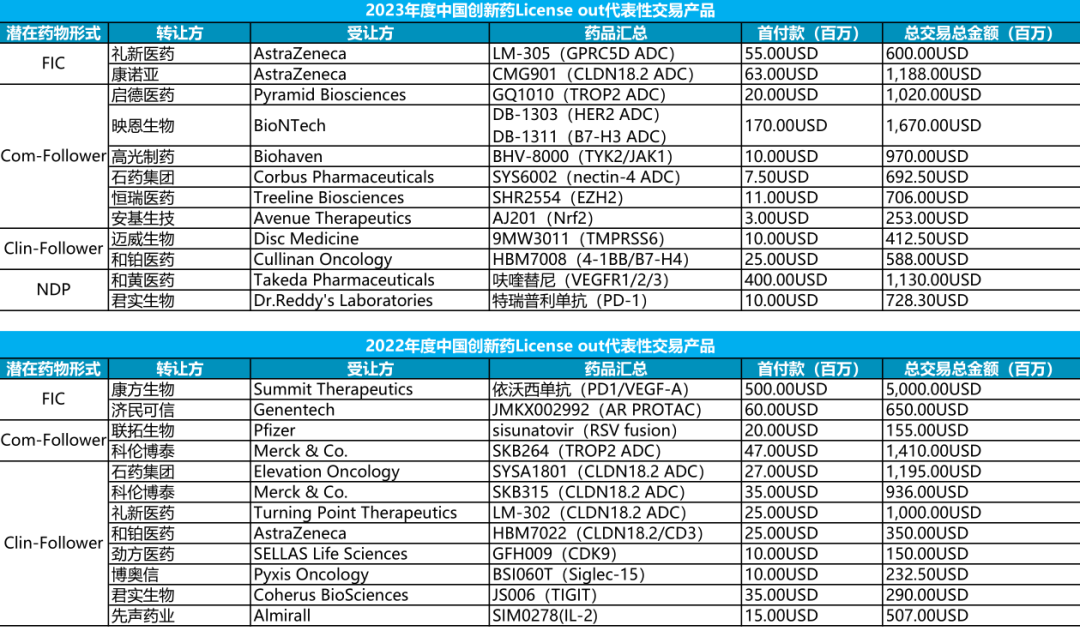
注:1.Com-Follower是指全球范围内同类产品上市(DB-1311除外);Pre-Follower指尚未有同类产品获批;NDP指国内已批准的药物
通过分析成功实现License out交易的药物目录和特征,似乎可以发现国外企业对于中国创新药感兴趣的产品大抵分为以下几类产品,且在药物特征上也有着鲜明的差异。
▌ 孤勇的FIC
FIC(First-in-class)产品有着天然的最高风险属性,是创新产品中开发难度最高的一类产品。多数情况下,开发FIC药物的目标是填补现有治疗方法的空白或提供更有效、更安全和更便利的治疗选择,通常需要对特定的生物标志物、生理过程或分子靶点进行探索和干预,尤其靶向目标的鉴定和验证是国内企业较为缺失的能力。
近年来,尽管中国创新企业的实力不断提升,药物开发能力不断得到验证和认可。但是,真正能够被全球广泛认可的FIC药物,依旧了然无几。不过,在中国工程师红利之下,随着药物技术的不断发展,基于技术的FIC产品开始不断出现。这类产品似乎都有着共同特征,那就是靶点可能并不自主发现,但通过技术手段挖掘出全球新颖的分子结构,包括药物形式和药物种类的创新,如抗体药物演变为ADC、小分子转化为降解剂,单克隆抗体发展为特异性双抗、多抗等形式。这类药物的优势便是靶点的成药性风险相对降低,成功率有所保证,而临床价值也潜在地提高,成为国外企业认可的创新形式,他们也乐于为此买单。
当然,这类药物的技术壁垒并不牢固,因此我们仅将同类产品的首个临床药物称为FIC,比如礼新医药的LM-305(GPRC5D ADC)和康方生物的依沃西单抗(PD1/VEGF-A)便是这类产品的两种典型代表。
这类药物的License out交易表现也跟靶点药物的整体发展阶段、成药性价值、适应症潜力以及转让方的BD能力和受让方的财力等多种因素相关。但是,就技术而言,LM-305是将未成药的GPRC5D单抗或双抗临床潜质转化为另一种药物的表现形式。显然,GPRC5D单抗或双抗已经在多发性骨髓瘤中表现出不俗的临床潜力,ADC产品如果能够在安全性上得到保证,叠加化疗的优势可能会令其也有着不俗的表现。对于CLDN18.2而言,亦是如此。
然而,康方生物的依沃西单抗(PD1/VEGF-A)则是再次发挥已经成药的PD-1临床价值。就康方生物的依沃西单抗而言,很明显是希望将PD-1免疫疗法的临床获益进一步扩大,但这类药物已经存在相关靶点的上市产品,可能需要通过头对头的研究为自己证明。
显然,这种基于机制的技术创新产品的确值得关注,也会成为License out标的。如EGFR/MET单抗埃万妥单抗获批上市之后,EGFR/MET ADC或许就会成为License out的交易对象;HER3 ADC在NSCLC领域表现的潜质,或许会促使EGFR/HER3 ADC成为License out的关注目标。
不过,通过技术创新实现FIC的药物也并非完全没有风险,还需要具体分析。无论是国内还是国际,亦或那种药物形式,最终都不能逃避与标准药物的临床对比,创新产品在机制上已被验证或具有潜在协同性,会增强胜出的概率,在认知上也更容易接受,这类产品的License out交易大抵也会走的比较顺利。
▌ 速度为王的Follower
尽管中国创新药起步晚、发展时间短,但在跟随式创新药(Fsat follow)的入局起点和开发速度确实在不断提前和加速,也让Fsat follow面临着不同的开发境遇。
在此,为明确分析这类药物的License out潜力和差异,将其分为Com-Follower和Clin-Follower。其中,Com-Follower是针对在全球范围内已经出现上市产品,而Clin-Follower则是指尚未出现获批药物。这样分类并没有特殊意义,仅为明显区分和描述License out产品潜力和差异。
不难理解,对于Com-Follower而言,这类产品最大的挑战就是将要直接面对同类产品的竞争(compete)。在不具备先发速度优势之后,产品的真正差异化潜质和优势就显得格外重要。只有实现这种差异化,并在商业化竞争中能够转化为优势,才能成为License out长久追逐的目标。
映恩生物的DB-1303和启德生物的GQ-1010就分别在毒素潜力和偶联技术上显著地呈现了这种差异。
对于Clin-Follower,开发进度和速度依旧是达成交易最为重要的因素。中国创新药企高效的新药开发成果让License in“降速”,却成为License out的提速器,CLDN18.2 ADC便再一次演绎这种影响。
CLDN18.2已经成为ADC赛道最内卷的靶点之一,国内已经有10余款产品进入临床开发。不过,对于受让方而言,最内卷的靶点也代表会有更多的选择余地(品种)。然而,阿斯利康依然选择了速度更为靠前的CMG901,也为此付出了目前同类产品中最高的首付款。
总的来说,Fsat follow模式下“带头大哥”的“喜怒悲欢”对受让方的选择有着至关重要的影响。但是,对于转让方而言,如何将产品做精做优是永恒不变的战略。追求短期的速度优势可能会带来暂时的显著回报,但只有打造卓越的产品才能避免遭遇退货的尴尬,并为企业带来长期的利益。
▌ 乾坤已定的NDP
相对于临床或临床前产品的License out交易,已经获批上市的新药产品(NDP)也有机会成为标的。尽管,目前针对国内创新产品的这类交易相对较少,但确实也存在这样的情况。
引进已经获批上市的新药产品的确具有明显优势,但同时也可能存在一些确定的劣势。优势方面,这些产品已经通过了监管机构的审查,安全性和有效性多数情况下更为直观,可谓乾坤已定。
但是,引进已上市新药产品也面临一些劣势。首先,受让方会更加重视产品与自身领域或产品管线的匹配度和协同性,以及其如何与现有产品组合和整体战略相适应。因此,受让方不免会慎重考虑产品在其业务中的定位和增值潜力。其次,引进已上市的新药产品价格相对较高,这或许也是其劣势。另外,受让方还可能会考虑当前的临床数据是否能够经得起国际化的考验,特别是在礼来和EQRx退回国内上市产品的权益案例之后,受让方对于产品的临床数据会更加审慎。如果无法在国际市场上取得成功,或许会选择相对较便宜且具备潜力的临床产品,以便更好的规划研发战略。
因此,对于真正有志于国际化的创新企业来说,应提前着眼于国际化战略,并进行谋划和布局,将是明智的选择。此前,PD-1经历的灵魂拷问,让我们注意到中美监管和临床治疗标准的差异,通过真正布局国际化便能避免这种情况的再次发生,毕竟国内还可以凭借海外数据提交上市。同时,拥有符合国际标准的临床数据和监管认可,将更有可能吸引国际合作伙伴进行License out交易,这种底气和资格可以增强企业在交易谈判中的地位和议价能力。
总之,无论是哪种类型的药物技术、哪些靶点产品,以及License out发生在何种阶段,为确保持久的授权目的最重要的因素还是将产品做好、做优,并基于不同的战略目的寻找最优策略来达成速度优势。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..