引言
近年来,License out模式已成为中国创新药企业“借船出海”的重要选择,创新药企业License out交易日趋活跃,交易数量、金额及项目种类方面呈逐年增高态势。2023年上半年中国生物医药License out交易TOP10事件的交易总额达117.833亿美元。从交易金额看,共有6起License out交易金额突破10亿美元,单项最高交易金额达20亿美元,为百力司康与卫材关于BB-1701的合作协议。
从产品方向来看, License out交易项目逐步多元化,从早期的单一产品逐步拓展到系列产品组合。从治疗领域来看,60%的License out产品主要集中在肿瘤领域,较往年占比呈下降趋势。从研发阶段来看,交易项目研发阶段由上市后阶段向临床及临床前期逐渐推进。
表1:2023年上半年中国生物医药十大License out许可交易事件
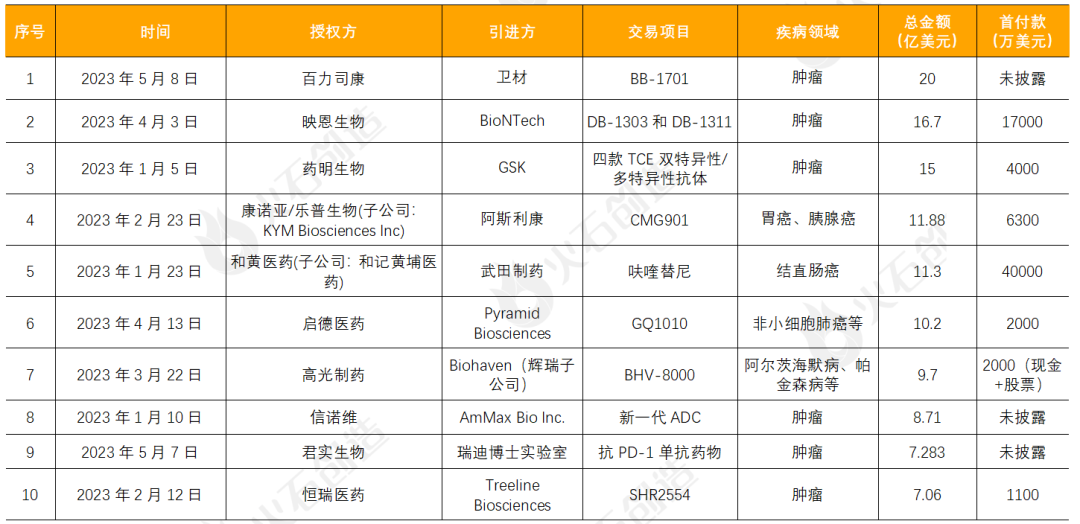
来源:火石创造根据公开资料整理
01
BB-1701
授权方:百力司康
引进方:卫材
2023年5月8日,致力于开发差异化抗体偶联药(ADC)的临床阶段生物医药公司百力司康宣布与卫材株式会社就BB-1701达成具有战略合作选择权的临床试验合作协议。根据协议,百力司康将获得首付款和里程碑付款,百力司康和卫材将就BB-1701进行共同开发。如卫材行使BB-1701战略合作的选择权,百力司康会获得相应的行权付款,同时将获得总计高达20亿美元的开发与商业化里程碑付款, 以及销售分成,卫材会获得BB-1701的全球(除大中华区外)开发和商业化权益。
BB-1701是一款由百力司康开发的以艾立布林为毒素的治疗癌症的人表皮生长因子受体-2(HER2)ADC创新药,旨在为局部晚期和转移性HER2阳性实体瘤患者提供更加安全有效的治疗方案, 具有应用于多种肿瘤适应症的市场前景。BB-1701具有独特的作用机制(MOA),包括有效的旁路杀伤效应以及免疫原性细胞死亡(ICD)活性,目前正在进行中美I/II期国际多中心临床试验,已有上百例不同癌种患者用药。
02
DB-1303和DB-1311
授权方:映恩生物(DualityBio)
引进方:BioNTech
2023年4月3日,专注于发现和开发下一代抗体偶联药物(ADC)以治疗癌症和自身免疫性疾病患者的临床阶段生物技术公司映恩生物(DualityBio)宣布就两款ADC产品(DB-1303和DB-1311)与BioNTech签订独家许可和合作协议,BioNTech将获得在全球范围内开发、制造和商业化这两款ADC(不包括中国大陆,香港特别行政区和澳门特别行政区)的权利。
根据协议条款,映恩生物将获得总计1.7亿美元的首付款,以及两款ADC产品的开发、监管和商业里程碑付款,总额可能超过15亿美元。映恩生物还将有资格从两款ADC产品的净销售额中获得高达低双位数的分层特许权使用费。
DB-1303是一种基于拓扑异构酶-1抑制剂的ADC候选药物,针对人表皮生长因子受体2(HER2),该靶标在多种癌症中过度表达,有助于癌细胞的侵袭性生长和扩散。靶向HER2的抗体疗法已被证明是表达HER2的癌症的有效治疗策略。DB-1303是由映恩生物专有的Duality免疫毒素抗体偶联物(DITAC)平台构建的第三代HER2 ADC产品,在HER2阳性和HER2低表达细胞和肿瘤模型中均表现出有效的抗肿瘤活性,具有良好的安全性和可能扩大的治疗窗口。DB-1303项目获得了美国食品和药物管理局(“FDA”)的快速通道指定,目前正在进行2期临床试验(NCT05150691),用于表达HER2的晚期实体瘤。
DB-1311同样是基于拓扑异构酶-1抑制剂的ADC候选药物之一,是一款由映恩生物专有的DITAC接头有效载荷组成的ADC。它在代表多种癌症类型的一系列肿瘤模型中表现出有效的抗肿瘤活性,并且在临床前研究中具有良好的耐受性,具有良好的药代动力学特征。临床前抗肿瘤活性及其安全性所证明的宽治疗窗口支持DB-1311解决各种癌症中未满足的医疗需求的潜力。
03
四款TCE双特异性/多特异性抗体
授权方:药明生物
引进方:GSK(葛兰素史克)
2023年1月5日,全球领先的合同研究、开发和生产(CRDMO)服务公司药明生物宣布与葛兰素史克(GSK)达成许可协议,GSK将获得基于药明生物专利技术平台开发的至多四款TCE双特异性/多特异性抗体的独家权利。
根据协议,GSK将获得一款处于临床前阶段的双特异性抗体和其他至多三款处于早期发现阶段的TCE抗体的全球独家研究、开发、生产和商业化权利。该款双抗分别靶向肿瘤细胞表面的肿瘤相关抗原(TAA)和T细胞表面抗原CD3,通过与肿瘤细胞及T细胞结合,特异性激活T细胞,从而杀伤肿瘤细胞,产生抗肿瘤活性。药明生物将获得4000万美元首付款和最高达14.6亿美元的四款TCE抗体的研究、开发、注册和商业化里程碑付款。药明生物也有资格获得基于净销售额的分级销售提成。
WuXiBody®是药明生物具有自主知识产权的双特异性抗体技术平台。该平台突破了绝大多数双特异性抗体平台技术瓶颈,具有表达量高、稳定性高、溶解度好、易于纯化等优势,并且能够为每个项目节约6到18个月研发时间以及显著降低双特异性抗体生产成本。WuXiBody®平台几乎可将所有抗体序列用以构建双特异性抗体,并且有望降低免疫原性风险及延长其体内半衰期。WuXiBody®平台还兼具独特的灵活性,可以构建各种不同的价数(如二价、三价或四价双特异性抗体),以满足不同项目的生物学特性需求。
04
CMG901
授权方:KYM Biosciences(康诺亚和乐普生物成立的合资企业)
引进方:阿斯利康
2023年2月23日,阿斯利康与 KYM Biosciences Inc.已就潜在世界首创靶向Claudin 18.2的抗体偶联药物(ADC)CMG901达成全球独家授权协议。Claudin 18.2是一个有前景的胃癌治疗靶点。根据授权协议,阿斯利康将负责CMG901的全球研发、制造和商业化。基于此协议及条款,由乐普生物和康诺亚合资设立的KYM Biosciences Inc.将获得6300万美元的预付款和超过11亿美元的潜在额外研发和销售相关的里程碑付款,以及高达低双位数的分层特许权使用费。阿斯利康将获得 CMG901 研究、开发、注册、生产和商业化的独家全球许可。该交易预计于 2023 年上半年完成,具体取决于惯例成交条件和监管许可。
CMG901 是首个在中国及美国均取得临床研究申请批准的靶向 Claudin 18.2 的全新重组人源化单克隆抗体偶联药物,由抗 Claudin 18.2单克隆抗体、可裂解的链接体和细胞毒性小分子单甲基澳瑞他汀E (MMAE)组成。CMG901正被开发用于包括胃癌在内的细胞表面表达 Claudin18.2 蛋白的实体肿瘤的治疗。CMG901由KYM Biosciences Inc.(KYM)所有,KYM 是康诺亚(KYM 70%的所有权)和乐普生物(KYM 30%的所有权)成立的合资企业。
05
呋喹替尼
授权方:和记黄埔医药(和黄医药子公司)
引进方:武田制药
2023年1月23日,和黄医药(中国)有限公司宣布其子公司和记黄埔医药(上海)有限公司与武田制药达成独家许可协议,在除中国内地、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。呋喹替尼在中国内地、香港和澳门由和黄医药销售。和记黄埔医药(上海)有限公司将获得总额高达11.3亿美元的付款,其中包括协议完成时4亿美元的首付款,以及潜在的监管注册、开发和商业销售里程碑付款,并外加基于净销售额的特许权使用费。该项协议计划于2023年完成在美国、欧洲和日本的上市许可申请提交。该交易的生效取决于一些惯例性成交条件,包括完成反垄断监管审查。在满足这些条件后,武田制药将全权负责呋喹替尼在除中国内地、香港和澳门以外的全球所有地区的开发和商业化。
与此同时,和黄医药将继续与礼来公司合作,专注于推进呋喹替尼在中国内地的后期临床试验和商业化。呋喹替尼在中国内地已获批,并以商品名爱优特®上市销售,用于治疗既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗血管内皮生长因子(“VEGF”)治疗和/或抗表皮生长因子受体(“EGFR”)治疗(RAS野生型)的患者。爱优特®自2020年1月起获纳入中国国家医保药品目录。
呋喹替尼是一种高选择性、强效的血管内皮生长因子受体(“VEGFR”)-1、-2及-3抑制剂。呋喹替尼可通过口服给药,并有潜力用于转移性结直肠癌的各种亚型中且不受生物标志物状态影响。呋喹替尼用于治疗难治性转移性结直肠癌患者的FRESCO-2国际多中心III期临床试验已取得积极结果,并于2022年9月举行的欧洲肿瘤内科学会(“ESMO”)年会上公布。FRESCO-2研究在转移性结直肠癌患者中达到了改善总生存期(“OS”)的主要研究终点,且一般耐受性良好。
06
GQ1010
授权方:启德医药
引进方:Pyramid Biosciences
2023年4月13日,专注于为癌症患者开发变革性药物的私营临床阶段生物技术公司Pyramid Bioscience宣布已与总部位于中国的私营生物技术公司GeneQuantum Healthcare(苏州)有限公司签订独家许可协议,获得在全球(除大中华区(中国大陆、香港、澳门和台湾))开发和商业化GQ1010,这是一种潜在的针对TROP2的同类最佳抗体药物偶联物(ADC),GQ1010显示出高度差异化的临床前特征,预计将在未来12个月内进入首次人体试验。
根据协议条款,Pyramid Biosciences将开发和商业化GQ1010,启德药物将获得2000万美元的预付款和10亿美元的额外里程碑付款,GeneQuantum还将有资格获得基于净销售额的特许权使用费。
GQ1010通过GeneQuantum在开发差异化生物偶联药物(如抗HER2 ADC)方面,尖端技术展现了在同类药物中的最佳潜力。GQ1010采用独特的位点特异性偶联技术,并结合了一种新的链接(linker-payload),可提高ADC的稳定性、安全性和效力。临床前数据表明,与更先进的TROP2 ADCs相比,GQ1010具有更广泛的治疗余量,这可能转化为GQ1010的疗效和安全性的改善。TROP2是一种细胞表面糖蛋白,在乳腺癌、肺癌、胰腺癌、卵巢癌和前列腺癌等多种肿瘤中高表达,并在肿瘤细胞增殖中发挥作用。
07
BHV-8000(TLL-041)
授权方:高光制药
引进方:Biohaven(辉瑞子公司)
2023年3月22日,Biohaven Ltd宣布与杭州高光制药有限公司达成在大中华区域以外的独家开发与许可协议,引进高光制药研发的TLL-041。根据协议,Biohaven将支付2000 万美元首付款(现金+股票)、9.5亿美元里程碑款及多层次、比例不等的销售分成。Biohaven 将在2023 年启动临床Ⅰ期,双方在全球协作进行临床开发。
TLL-041是全球首个具有通过血脑屏障能力的高选择性双靶点 TYK2/JAK1抑制剂。TYK2 和JAK1是处理一系列促炎症细胞因子的STAT通路调节剂;抑制这些激酶可能在减少神经系统疾病的炎症方面发挥重要作用,包括帕金森病、阿尔茨海默病、肌萎缩性侧索硬化症和多发性硬化症。TLL-041已经证明了对JAK2、JAK3 和其他激酶的高选择性,与选择性较低或无选择性的JAK抑制剂相比,有可能提供更好的安全性。TLL-041的作用机理在多个临床前模型中得到证明。TLL-041由高光制药创始人梁从新博士发明,梁博士也是舒尼替尼、恩沙替尼、TLL-018等多个已上市新药、已进入上市申报阶段、临床Ⅲ期阶段新药的发明人。
BHV-8000(TLL-041)具有通过血脑屏障能力并对 TYK2/JAK1的双重抑制作用,为治疗脑部疾病提供了独特和极具吸引力的潜力。Biohaven将继续推动 BHV-8000 进入临床开发,并发掘神经免疫调节的潜力,以治疗急需新型治疗方案的严重神经系统疾病。
08
用于实体瘤治疗的新一代ADC
授权方:信诺维
引进方:AmMax Bio
2023年1月10日,致力于创新药研发的信诺维医药科技股份有限公司宣布与致力于在肿瘤领域研发创新性疗法的临床阶段生物医药公司AmMax Bio达成合作。双方就一款用于实体瘤治疗的创新性ADC达成除大中华区外的全球研发和商业化的独家转让权协议。该独家转让权协议包含双方协商好的授权条款(licensing terms),协议执行后,信诺维将获得最高达8.71亿美元的支付款,包含首付款和开发,注册及销售里程碑。同时按照本协议,双方将协作完成合作项目的IND申请以及剂量递增临床研究的设计。
该ADC采用新一代的毒素-链接(linker-payload)和抗体, 并已经在多种临床前动物模型中展现出优越的抗肿瘤活性,预期可用于多种实体瘤的治疗。同时,临床前的疗效和毒理研究表明该ADC具有更宽的治疗窗口。目前已有数据表明,该ADC的临床疗效和安全性特征对比同类ADC项目将会有大幅提高。
09
抗PD-1单抗药物特瑞普利单抗注射液
授权方:君实生物
引进方:瑞迪博士实验室(Dr. Reddy’s)
2023年5月7日,君实生物宣布与瑞迪博士实验室(Dr. Reddy’s)达成合作,在拉丁美洲、印度、南非对君实生物自主研发的抗PD-1单抗药物特瑞普利单抗注射液开展研发与商业化合作。此外,瑞迪博士实验室可选择将许可范围扩大至涵盖澳大利亚及新西兰以及其他多个国家。根据协议,君实生物可获得总额最高达7.283亿美元的首付款、里程碑付款和扩展区域的潜在合作款,外加含特瑞普利单抗的产品销售净额两位数百分比的特许权使用费。
根据协议条款,君实生物将向瑞迪博士实验室授予许可,于巴西、墨西哥、哥伦比亚、阿根廷、秘鲁、智利、巴拿马、乌拉圭、印度及南非开发及独占地商业化特瑞普利单抗。瑞迪博士实验室可选择在独占期内将许可范围扩大至涵盖澳大利亚及新西兰以及其他9个国家。
特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。 特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
10
SHR2554(EZH2抑制剂)
授权方:恒瑞医药
引进方:Treeline Biosciences
2023年2月12日,恒瑞医药股份宣布与美国Treeline公司达成协议,将具有自主知识产权的抗肿瘤药品SHR2554(EZH2抑制剂)项目有偿许可给Treeline公司。Treeline公司将获得在除大中华区以外的全球范围内开发、生产和商业化SHR2554的独占权利。协议签订10天内,Treeline将向恒瑞支付1,100万美元的首付款及6.95亿美元的开发、销售里程碑付款。同时,从SHR2554在许可区域启动商业销售开始,Treeline将按照约定比例(10%-12.5%),根据实际年净销售额向恒瑞支付销售提成。
SHR2554 为恒瑞自主研发且具有知识产权的 EZH2(zeste 基因增强子同源物2)抑制剂。2018年5月,SHR2554获批开展治疗复发/难治成熟淋巴细胞肿瘤的I期临床研究。2023年1月,SHR2554被国家药监局药品审评中心纳入突破性治疗品种名单,用于复发或难治的外周T细胞淋巴瘤。截至目前,该产品已投入研发费用约为8,938万元人民币。
与市场上其他同类产品相比,Epizyme公司(已被Ipsen收购)的同类产品Tazverik(tazemetostat)已于2020年1月被美国食品药品监督管理局(FDA)批准上市,用于治疗成人与16岁以上青少年转移性或局部晚期上皮样肉瘤(ES);同年6月,批准成人复发/难治性滤泡性淋巴瘤(r/rFL)适应症。其他同类产品还包括辉瑞公司的PF-06821497、第一三共制药的valemetostat和Constellation(已被Morphosys收购)的CPI-0209。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..