7 月 11 日,君实生物宣布,NMPA 已于近日受理其自主研发的抗 PD-1 单抗特瑞普利单抗联合阿昔替尼用于不可切除或转移性肾细胞癌(RCC)患者一线治疗的新适应症上市申请。
君实 PD-1 单抗新适应症报上市
当前,国产 PD-(L)1 抑制剂并未有申报晚期肾细胞癌,特瑞普利单抗为国产首款。
这是特瑞普利单抗在中国递交的第 9 项上市申请,此前已在国内获批 6 项适应症,且另有 2 项适应症已处于上市申请阶段。
特瑞普利单抗申报/获批适应症
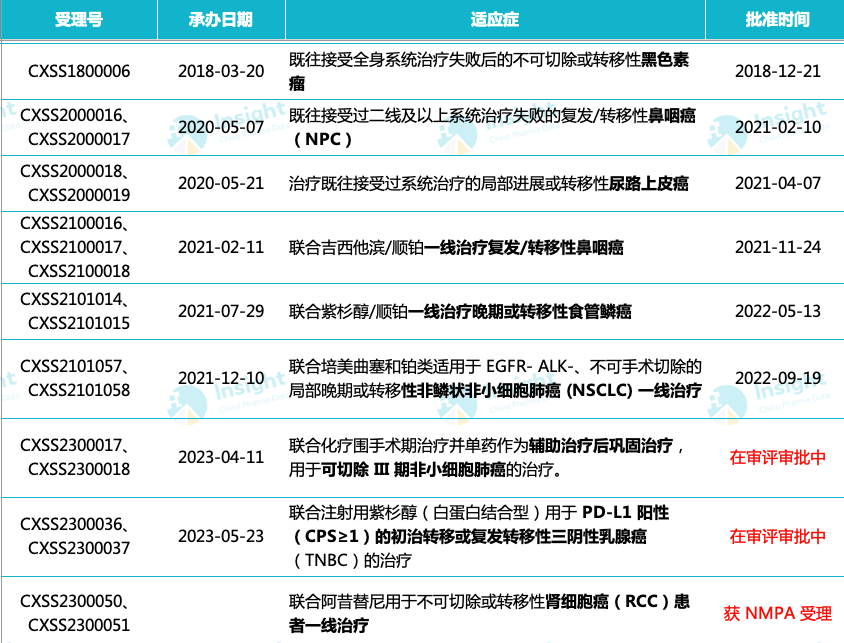
来自:Insight 整理(人工整理,如有纰漏请指正)
本次新适应症的上市申请主要基于 RENOTORCH 研究(登记号:NCT04394975)。
作为国内首个晚期肾癌免疫治疗关键 III 期研究,RENOTORCH 研究为一项多中心、随机、开放、阳性药对照的 III 期临床研究,旨在评估特瑞普利单抗联合阿昔替尼对比舒尼替尼一线治疗中高危的不可切除或转移性 RCC 患者的有效性和安全性。
主要研究终点是独立评审委员会(IRC)评估的 PFS,次要研究终点包括研究者评估的 PFS、IRC 或研究者评估的 ORR、缓解持续时间(DOR)和疾病控制率(DCR)、OS 以及安全性等。
北京大学肿瘤医院郭军教授和上海交通大学医学院附属仁济医院黄翼然教授为该研究的共同牵头主要研究者。研究于 2020 年 8 月启动入组,47 家国内中心参研,共随机入组 421 例受试者。
根据 RENOTORCH 研究的期中分析结果,相较于舒尼替尼,特瑞普利单抗联合阿昔替尼一线治疗晚期 RCC 患者可显著降低患者的疾病进展或死亡风险,同时改善 ORR 等次要终点。特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。关于详细的研究数据,君实将在近期国际学术大会上公布。
肾癌是全球泌尿系统第三位最常见的恶性肿瘤,而 RCC 占全部肾癌病例的 80%~90%。据统计,2022 年中国肾癌新发病例和死亡病例分别约为 7.7 万例和 4.6 万例。约三分之一的肾癌患者在初诊时已发生肿瘤远处转移,而局限性患者接受肾切除术后仍有 20-50% 出现肿瘤远处转移。
基于国际转移性肾细胞癌数据库联盟的风险分级,低危、中危和高危的转移性 RCC 患者接受抗血管靶向治疗的中位总生存期(OS)分别为 35.3、16.6 和 5.4 个月。因此,相较于低危患者,中、高危晚期 RCC 患者对新型治疗方案的临床需求更加迫切。
当前,针对晚期肾癌的标准治疗仍以 TKI 靶向药单药治疗为主,患者通过该方案的获益十分有限。而特瑞普利单抗该项新适应症的申报上市,意味着我国肾癌治疗领域有望迎来首个「免疫+靶向」联合疗法。
据 Insight 数据库显示,除特瑞普利单抗外,目前国内共有 4 款 PD-(L)1 抑制剂肾细胞癌适应症开发进度较快,分别为默沙东 K 药、BMS O 药、罗氏的阿替利珠单抗、正大天晴的 TQB2450,均处于 III 期临床阶段。
国际化布局更进一步
除国内进展外,君实也在大力推进特瑞普利单抗的国际布局。
目前,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA)正在接受 FDA 审评。
此前,在 5 月 31 日,君实生物的海外 PD-1 合作方 Coherus Biosciences 表示,FDA 已成功完成了特瑞普利单抗的批准前现场检查。
FDA 对其中三项检查结果给出了意见,需要企业方回应,不过,Coherus 认为这三条意见是容易解决的,该公司表示将与君实一同在 6 月初向 FDA 提交答复。
此前 Coherus 给出的获批预期为今年 Q3。特瑞普利单抗所申报的鼻咽癌适应症在美国属于罕见癌种,也是 K 药、O 药等前辈尚未踏足的领域。基于这一未满足的临床需求,特瑞普利单抗有望拿到 FDA 的积极反馈。
Coherus 业务发展预期
来自:Coherus 2023 年 3 月资料
除美国外,君实也已开始把目光投向美国之外的广泛地区,第一步布局欧洲,然后通过对外合作/授权向东南亚等广泛地区渗透。
君实生物将特瑞普利单抗的北美和加拿大权益授予 Coherus,欧洲则自主提交上市申请。
2022 年 12 月和 2023 年 2 月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。
此外,从去年年末到今年初,又通过 3 笔交易将海外布局拓展到了中东、南非、北非、东南亚等地区。
君实生物「特瑞普利单抗」对外合作和授权
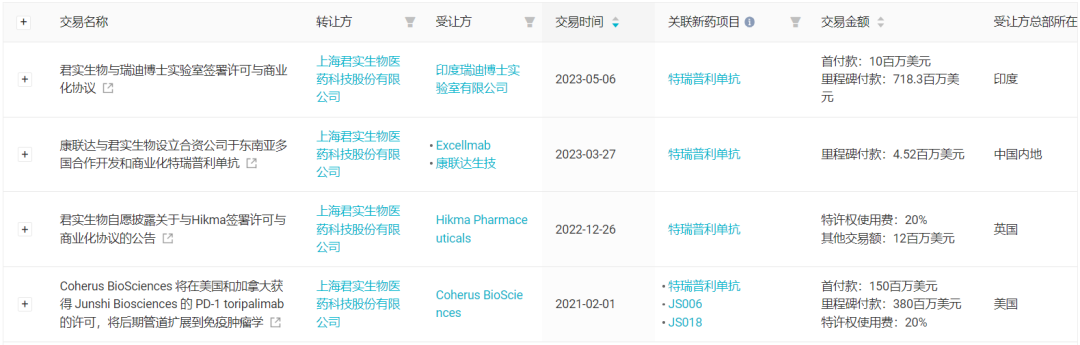
来自:Insight 数据库网页版
2022 年 12 月 26 日,君实生物与 Hikma 公司宣布达成合作,授予在约旦、沙特阿拉伯、阿联酋、卡塔尔、摩洛哥、埃及等中东和北非地区共 20 个国家开发和商业化的独占许可,并可获得合计最高达 1,200 万美元的付款,外加销售净额近 20% 的阶梯分成;
2023 年 3 月 28 日,君实生物与康哲药业子公司康联达生技共同宣布,将设立合资公司在东南亚地区 9 个国家,包括泰国、文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、越南,对特瑞普利单抗合作开发和商业化;
今年 5 月 5 日,君实生物与瑞迪博士实验室签署协议,同意授予许可于巴西、墨西哥、哥伦比亚、阿根廷、秘鲁、智利、巴拿马、乌拉圭、印度及南非开发及独占地商业化特瑞普利单抗;且瑞迪博士实验室可选择将许可范围扩大至涵盖澳大利亚、新西兰以及其他 9 个国家。

来自:君实财报
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..