铁死亡是细胞调控死亡的一种特殊形式,在癌症、缺血性器官损伤、退行性疾病等多种病理过程中发挥着重要作用。
目前,铁死亡监测主要有两种已知的调控机制:一种是谷胱甘肽过氧化物酶4(GPX4)介导磷脂过氧化物的还原;另一种是由酶介导的,如FSP1,通过产生具有自由基捕获抗氧化活性的代谢物终止磷脂过氧化以阻断铁死亡。
近日,来自纪念斯隆-凯特琳癌症中心的研究团队在Cell发表了相关文章[1],揭示了一种受性激素调控但不依赖于GPX4的铁死亡新监测机制,为开发新的联合治疗提供线索。

一、研究内容与思路
1、MBOAT2是独立于GPX4和FSP1的铁死亡抑制基因
为了鉴定新的铁死亡抑制基因,研究者用GPX4抑制剂RSL3和胱氨酸饥饿作为铁死亡诱导剂(FINs),在人纤维肉瘤HT1080细胞中进行了全基因组CRISPR激活筛选,结果发现7个基因的sgRNAs最富集。
其中,有5个已知的铁死亡抑制基因:SLC7A11,NFE2L2/NRF2,FSP1,GCH1和NOS2;另外2个是磷脂修饰酶MBOAT2和PLA2G2F,尚未被报道为铁死亡调节因子。
接下来,研究者通过细胞实验表明MBOAT2和PLA2G2F的过表达均能显著性抑制RSL3或者GSH耗竭引发的铁死亡。有趣的是,MBOAT2可以有效地抑制了GPX4/FSP1DKO细胞的自发性铁死亡。该结果表明,MBOAT2是一种有效的铁死亡抑制基因,其功能独立于GPX4活性和FSP1。
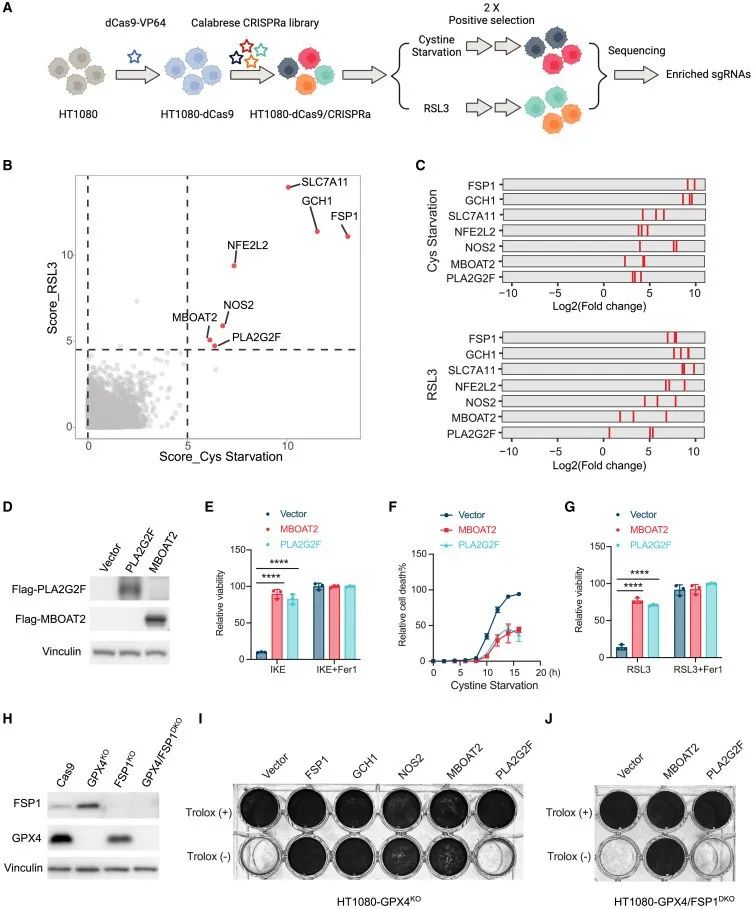
研究思路:研究者采用全基因组CRISPR激活筛选获得富集基因,进一步分析另外两个基因是否能够抑制铁死亡,最终发现研究主角MBOAT2。
2、MBOAT2抑制铁死亡需要内源性或外源性MUFA
基于之前研究:MBOAT2可以抑制RSL3诱导的脂质过氧化,SCD1通过将合成的饱和脂肪酸(SFAs)转化为MUFA。因此,研究者猜测MBOAT2是否是通过抑制脂质过氧化来抑制铁死亡,且是否与MUFA相关。
结果发现,TOFA诱导HT1080-GPX4KO细胞中MBOAT2的过表达,而在GCH1过表达的HT1080-GPX4KO细胞中未诱导铁死亡,表明MBOAT2在抑制铁死亡中具有特异性的脂肪生成作用。进一步探究MBOAT2与SCD1之间的关系,发现SCD1抑制剂减弱了MBOAT2对RSL3或GPX4敲除诱导的铁死亡的保护活性。
综上表明,MBOAT2可以利用从头合成途径生成的MUFA或者摄取的外源性MUFA来抑制铁死亡。而敲减MBOAT2,可以显著降低MUFA对于铁死亡的抑制功能。
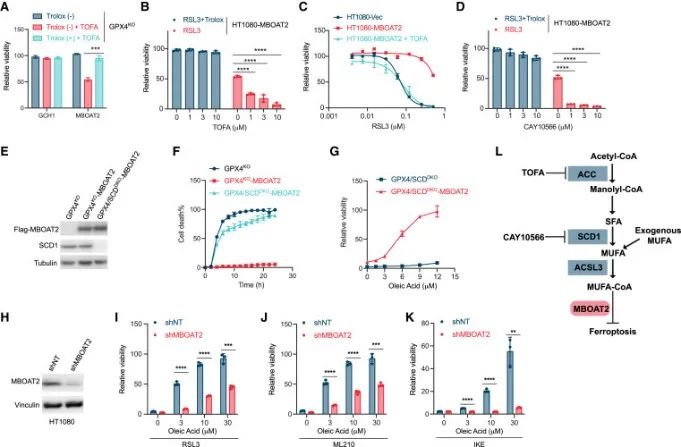
研究思路:明确了MBOAT2是铁死亡抑制剂后,研究者进一步探索了MBOTA2抑制铁死亡的方式,结合前人对于MBOAT2的研究结果发现,MBOAT2可以利用从头合成途径生成的MUFA或者摄取的外源性MUFA来抑制铁死亡。
3、MBOAT2通过磷脂重构抑制铁死亡
由于MBOAT2以MUFA依赖性方式抑制铁死亡,研究者试图确定MBOAT2是否通过磷脂重塑来抑制铁死亡。研究者对HT1080细胞进行了脂质组分析,发现MBOAT2过表达显著下调PE-PUFAs(PE-PUFAs可发生脂质过氧化来诱导铁死亡,是铁死亡灵敏度的主要决定因素),增加PE-MUFAs,而PCMUFAs和其他PL-MUFAs没有受到显著影响。
实验结果也证实了MBOAT2过表达后PE-PUFAs显著降低,PE-MUFAs显著增加,PE重塑将使细胞处于高PE-MUFA水平但低PE-PUFA水平的状态。此外,研究者还发现,MBOAT2酶活性对于抑制铁死亡是必不可少的。
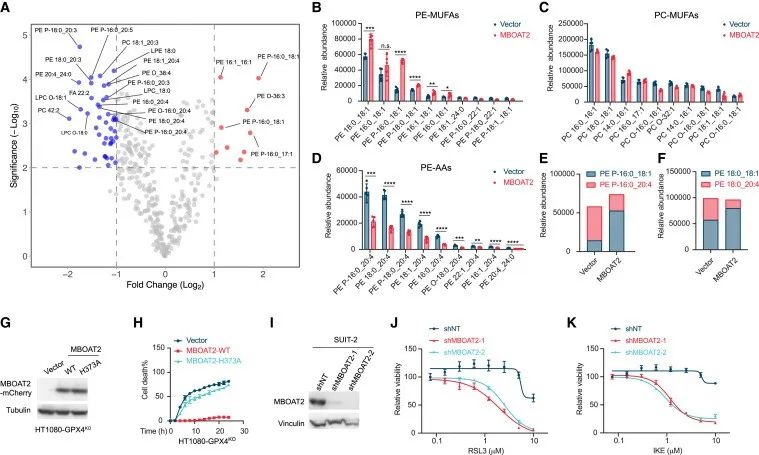
研究思路:研究者结合MBOAT2与脂质代谢的关系,以及上述所得结果MBOAT2可以利用MUFA来抑制铁死亡,进而进行了脂质组分析,发现MBOAT2过表达显著下调PE-PUFAs来抑制铁死亡。
4、雄激素受体(AR)信号通路通过MBOAT2调节前列腺癌的铁死亡
研究者发现,MBOAT2在前列腺癌(PCa)中经常上调。通过一系列实验作者证实了MBOAT2是前列腺癌细胞中AR的真正靶点。通过分析PCa细胞株,发现MBOAT2在AR+PCa细胞株中高表达,而在AR-PCa细胞株中不表达。重要的是,AR+PCa细胞系普遍更能抵抗铁死亡。
通过脂质组学分析,研究者发现MBOAT2显著降低PE-PUFAs的含量,重塑细胞磷脂组分。因此,AR信号通路通过上调MBOAT2的表达,进而重塑细胞磷脂组分,促进AR+PCa细胞对铁死亡抵抗。后续,研究者还采用了AR降解剂ENZ来抑制AR表达,发现AR拮抗剂使AR+PCa对铁死亡敏感,表明AR通过MBOAT2调节前列腺癌的铁死亡。
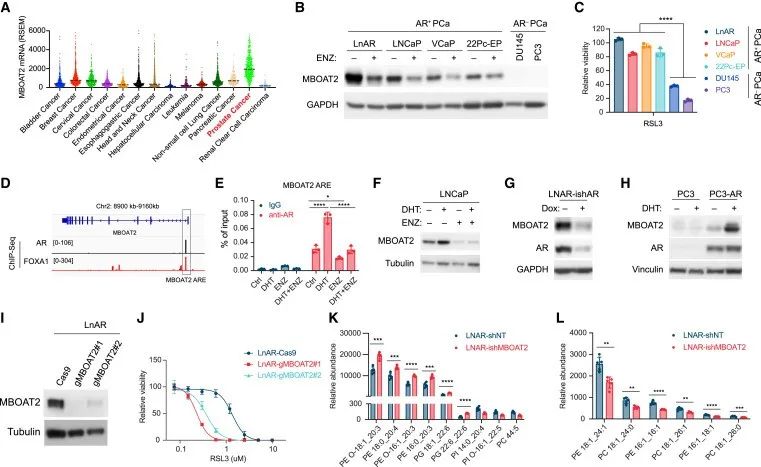
研究思路:MBOAT2抑制铁死亡的下游作用机制已经明确了,那么有无调控MBOAT2的上游作用机制呢?基于此,研究者根据MBOAT2在前列腺癌(PCa)中经常上调这一情况开展了后续实验,最终发现AR通过MBOAT2调节前列腺癌的铁死亡。
5、MBOAT1是另一个MUFA首选的铁死亡抑制蛋白,受雌激素受体(ER)调控
研究者发现,MBOAT1也能挽救GPX4或RSL3敲除所致的铁死亡。ACC抑制剂TOFA或SCD1抑制剂CAY10566消除了MBOAT1过表达的保护功能。脂质组分析中发现4种PE-OAs中有3种显著增加,4种PE-AAs中有3种显著减少。此外,MBOAT1显著减少RSL3诱导的脂质过氧化,这可能是PE-AA减少的结果。与MBOAT2相反,MBOAT1在女性癌症中高表达。实验分析证实在ER+BCa细胞系和三阴性BCa (TNBC)细胞系中,MBOAT1的表达在ER+BCa中上调,并起到抑制铁死亡的功能。综上所述,MBOAT1是ER的直接转录靶点。
这些结果表明,在ER+和AR+肿瘤中,MBOAT1和MBOAT2分别受到不同的调控以抑制铁死亡。
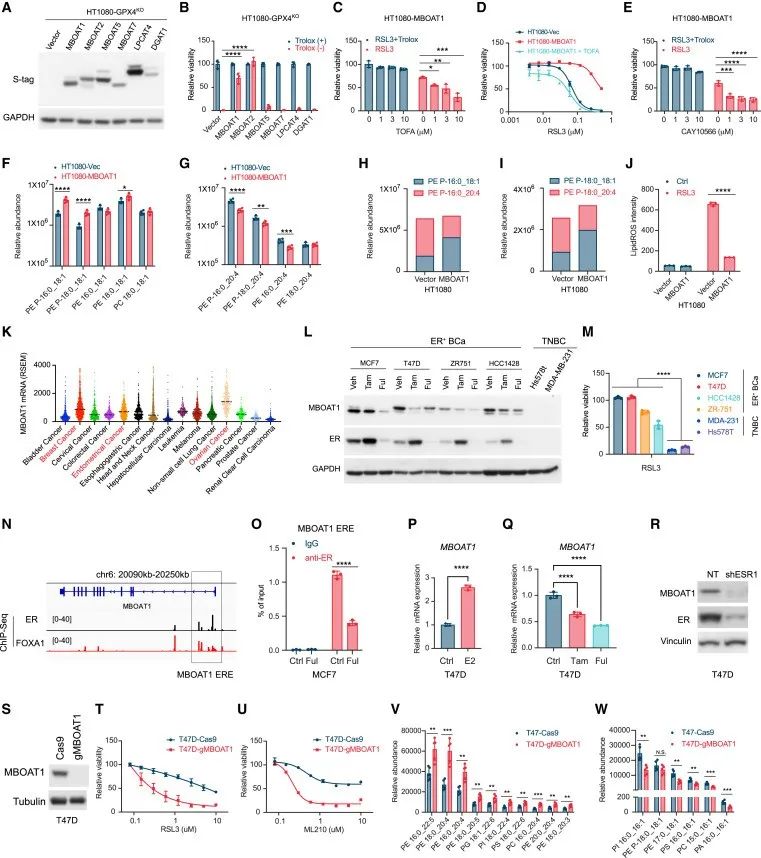
研究思路:到第四部分的时候,该研究已经很完善了,但在上述研究中研究者发现在HT1080-GPX4KO细胞中,即使MBOAT2被敲除,sCD1的过度表达仍能促进细胞存活,提示存在能催化PL-MUFA合成的其他途径。对此,研究者从MBOAT2家族成员入手,发现MBOAT1,并表明MBOAT1是ER的直接转录靶点,与女性癌症铁死亡息息相关。
二、研究小结
在本研究中,研究者通过全基因组CRISPR激活筛选获得了磷脂修饰酶MBOAT2为铁死亡抑制因子并进行了验证,结果与猜想一致,研究者还完善了新铁死亡抑制因子MBOAT2的上下游作用通路。此外,这一家族的另一成员MBOAT1也可以通过调控PE- MUFA偏好的PE重塑机制抑制铁死亡,且二者的铁死亡监测功能独立于GPX4或FSP1。
综上所述,这一系统性的研究揭示了一种调控铁死亡监测的新分子机制,即性激素信号可以通过MBOAT1/2介导的磷脂重塑抑制癌细胞铁死亡。
参考文献:
[1] Liang D, Feng Y, Zandkarimi F, et al. Ferroptosis surveillance independent of GPX4 and differentially regulated by sex hormones [published online ahead of print, 2023 May 23]. Cell. 2023;S0092-8674(23)00522-6.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..