
(图片来源:网络)
2023年1月6日,美国食品药品监督管理局(FDA)加速批准了卫材和百健联合开发的阿尔茨海默病(AD)新药Leqembi (lecanemab)单抗,中文名“仑卡奈”,药时代简称其为L药。
这款新药以早期AD患者为对象,可以清除患者脑部的致病物质β淀粉样蛋白斑块。作为第一个明确表明减少淀粉样蛋白会给患者带来临床获益的药物,仑卡奈单抗可能成为AD治疗新的里程碑。
5个月后,2023年6月9日,FDA外周和中枢神经系统药物咨询委员会举办会议,六名有投票权的成员参加,其中一名是患者代表,最终以6比0的投票结果一致赞成全面批准该药。
该药预计将于7月6日或之前获得全面批准,这将为那些患有轻度认知障碍或轻度痴呆并确认存在β淀粉样蛋白病理但不能或不想支付每年26,500美元定价的患者提供更广泛的保险覆盖。
在上周五的会议上,有投票权的成员都赞成Leqembi积极的风险收益对比。作为一名委员会成员,哈佛医学院的Cudkowicz医学博士表示,Leqembi的临床疗效证据是明确的,她印象深刻的是,这种效果很早就被发现,而且随着时间的推移而增强。
她补充到,“对于这种疾病,患者没有太多的药物可选,这些都是有意义的改变。”
另一名委员会成员、西北大学范伯格医学院神经学教授Simuni博士表示,“每个人都在纠结的问题”是临床意义是什么。“这绝对是一个很小的改变,必须放在疾病早期这一背景下考虑。”
委员会首席成员、班纳阿尔茨海默病研究所首席科学官Alexander博士重申,总体而言,该公司清楚地展示了这是一款针对其面向的患者群体有效的治疗方法。他还指出,小组成员普遍对Leqembi的功效表示强烈支持。
在此次投票之前,一项名为CLARITY AD的关键安慰剂对照试验取得了积极的结果,结果显示,与安慰剂相比,Leqembi在18个月后减缓了27%的认知和功能衰退速度。多伦多记忆项目(Toronto Memory Program)医学主任Cohen博士上周五代表卫材发表演讲时表示,文献和阿尔茨海默病专家均表示,疾病减缓20-30%在临床上是有意义的。
FDA和卫材指出,脑肿胀和脑出血等副作用也被提及,但据称是可以在密切监测下得到控制的。
Cudkowicz医学博士还询问FDA可能会收集什么样的数据来提示Leqembi使用的不确定性。FDA神经科学办公室代理主任布拉奇奥博士指出了Leqembi加速批准下的某些安全监测措施,并指出卫材需要提交加速报告并收集更多不良事件数据。她指出,Leqembi和百健的另一种抗淀粉样蛋白药物Aduhelm (aducanumab)也正在收集相关数据,随着更多的数据的获得,FDA可能会更新标签。
FDA评审员在6月7日发布的简报文件中还称,卫材和百健为证明他们的阿尔茨海默病新药具有临床益处而进行的验证性试验确实展示临床益处,Leqembi可能会在下个月获得全面批准。
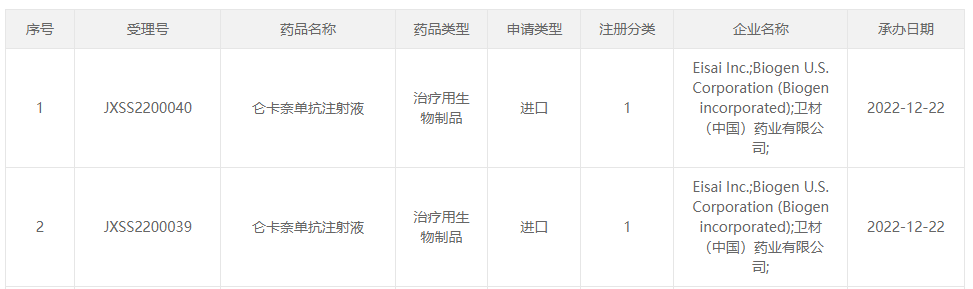
2022年12月22日,CDE官网显示,仑卡奈单抗的上市申请获NMPA受理。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..