今年4月初,在 JAMA Health Forum 和 The New England Journal of Medicine 上的多篇期刊指出:目前加速批准药物上市后的验证性研究出现逾期问题,这使患者面临一种不确定临床益处的情况。这有违加速批准政策的初衷,因此针对加速批准政策的改革迫在眉睫。改革需要提高FDA关于是否撤回加速批准药物的决策权力和严格监管加速批准药物的上市后研究。
01
新药加快上市的通道
美国食品和药物管理局(FDA)目前为推动新药加快上市设置了5个相关通道:优先审批(Priority Review),快速通道(Fast Track),突破性疗法(Breakthrough Therapy),加快批准(Accelerated Approval)和孤儿药认定(Orphan Drug Designation, ODD)。
● 1983年,美国开始使用孤儿药机制,用来鼓励、加速罕见病药物的上市。获得FDA孤儿药身份后,将享有税收减免、免除申请费、研发资助、加快审批以及上市后7年的市场独占权。2017年FDA发布“孤儿药现代化计划”,提出所有新申请须在90天内得到回应。
● 1988年,FDA启动快速通道机制,加速药物临床评估进程。允许药企在包括没有临床数据的任何研发阶段都可以提出申请,FDA在收到申请的60天内给出答复。
● 1992年,为应对HIV-AIDS危机和其他严重和危及生命的疾病,FDA创立了药品加速批准机制,允许利用替代终点加速药物审批上市,旨在将急需的药物快速推向市场。
● 1992年还设立了优先审评机制,但此机制只针对药物审评阶段,审评阶段从10-12个月缩短到6-8个月,而对临床试验没有影响。
●2012年FDA设立突破性疗法通道,主要针对药物的适应症申请,对药物的筛选更严格。使用该通道不但享有“快速通道”的所有权利,还能得到FDA从一期临床试验开始的格外关照。

图1 FDA总部外景(GettyImages)
02
加速批准政策
传统药物审批需要证明临床疗效才能申请上市,而针对严重威胁生命又无有效治疗方案的疾病,可采用预测临床疗效的替代终点或中期临床终点来加速药物上市,因此目前加速批准的药物大多是针对病程较长的癌症和艾滋病。采用观测替代终点和中期临床终点的方法可以使处于紧急疾病环境下的患者尽快接受可能有益的治疗方案。这些加速批准的药物在上市后仍需继续开展研究,来观测药物的临床疗效,以便FDA决定是否维持原来的批准。
替代终点是指预测药物疗效的指标,包括患者的感受,功能或生存状态,具体为实验室测量、X射线影像、体征或其他测量。例如,血浆中艾滋病毒载量的短期抑制;血液细菌清除率;肺结核患者的6个月随访治疗结果;地中海贫血患者体内的铁储备;某些类型癌症中肿瘤缩小的影像学证据。
中间终点是治疗效果的一种测量,可以在药物对不可逆转的死亡率或发病率产生影响之前被测量。FDA认为中间临床终点通常用于支持以下情况的加速批准:慢性疾病环境下的相对短期临床效益;基于约13个月复发率的研究;依据延迟分娩的证据批准治疗早产的疗法。根据加速批准,要求申请人继续上市后的验证性研究,确保治疗效果的持久性。
03
验证性试验的逾期问题被披露
FDA加速批准的药物仍然需要在后续试验中评估临床效益。FDA设定了一个完成的时间框架,但此类验证性试验有时会延迟。哈佛大学的AaronKesselheim和BenRome,以及乔治亚州立大学法学教授AnjaliDeshmukh发表在JAMAHealthForum的文章“Timing of Confirmatory Trials for Drugs Granted Accelerated Approval Based on Surrogate Measures From 2012 to 2021”试图系统地描述相对于FDA设定的截止日期的延迟验证性试验的频率。
他们使用FDA的公共数据来确定后续试验要求,以及FDA和制造商在2012年1月1日至2021年7月31日获得加速批准药物的截止日期。如果截至2021年9月15日,或制造商在商定的最后期限后撤回了适应症,或要求在最后期限后仍未得到执行,则试验被归类为逾期(late)。还确定了截至2021年9月15日要求未全部执行时制造商报告的延迟(delay)。
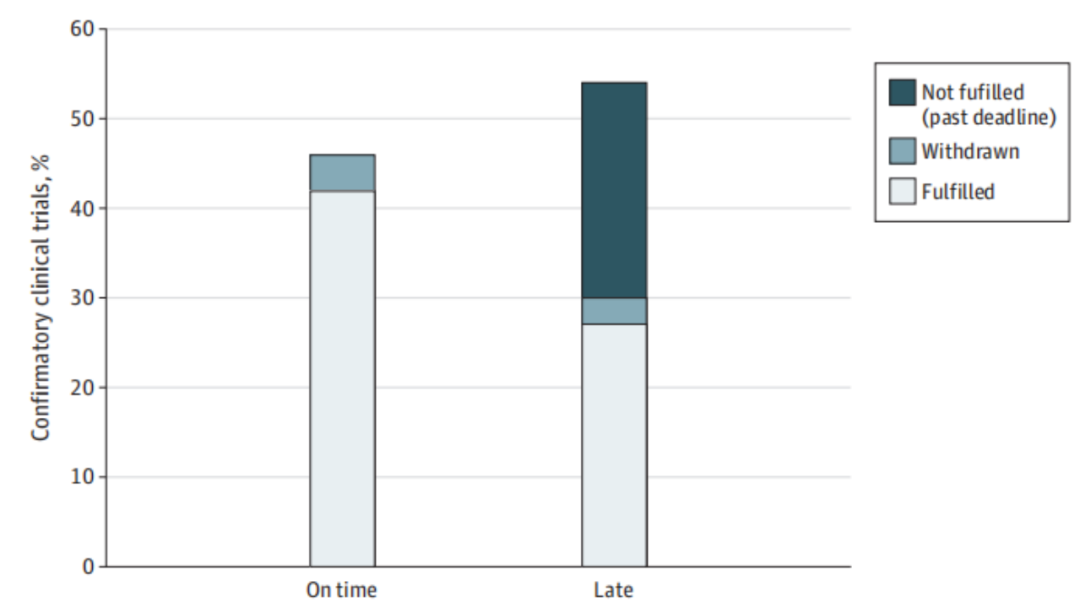
图2 FDA验证性临床试验的及时性
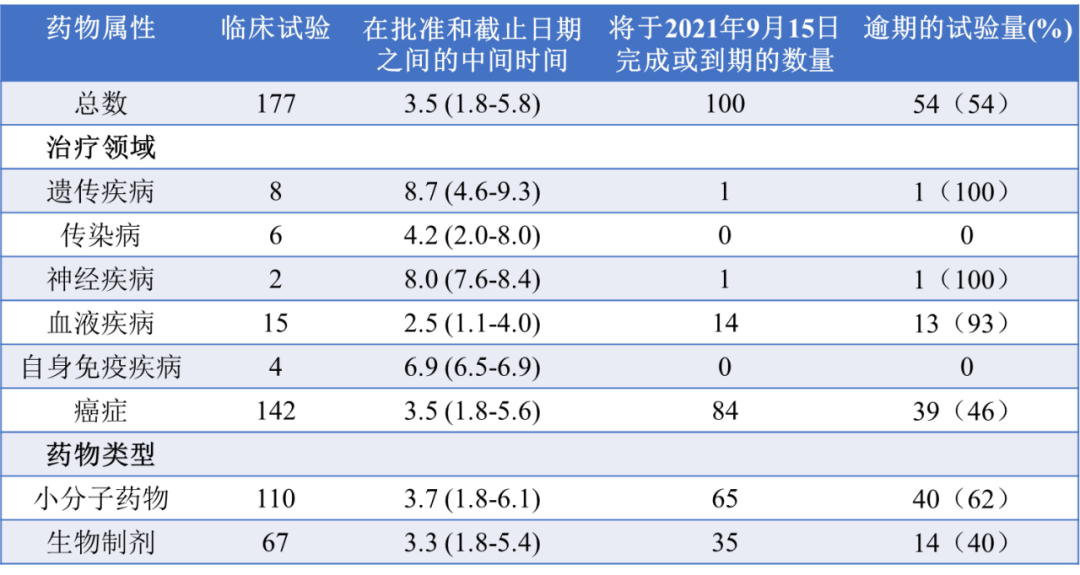
结果发现在140个新适应症中纳入了177个随访试验要求(每个适应症为0-4个试验要求)。完成验证性试验的中位时间为自批准之日起3.5年(IQR,1.8-5.8年),不同治疗领域有显著差异(表)。
●57%(100/177)的试验在2021年9月15日之前完成或到期,其中54%(54/100)的试验的时间为逾期。另外8%(14/177)的研究在截止日期前被制造商延迟报告给FDA。
●54项逾期试验中有39项涉及肿瘤学,另外13项涉及血液学,一项涉及神经学,另一项涉及遗传病。
●非肿瘤适应症的试验(93%[15/16)比肿瘤适应症的试验(46%(39/84)更有可能逾期。
●小分子药物的试验(62%[40/65])比生物制剂的试验(40%[14/35])更有可能逾期。
●在54项逾期需求中,27项在2021年9月15日完成,在期限后中位数为1.0年(IQR,0.7-1.9年),3项在期限后中位数为1.4年(范围,0.9-3.3年)。截至2021年9月15日,24个不完全延迟的平均超过最后期限为1.8年(IQR,0.6-2.2年)。
表 加速批准验证性试验要求的特点
基于不确定的疗效证据,加速批准加快了药物的销售,该过程依赖于及时的后续试验。但是目前发现超过一半的所谓验证性研究没有在规定的时间内完成。由于“不确定的临床益处”,不完整的验证性试验可能会伤害患者。
04
权威机构与期刊推进“加速批准”的改革
Aaron Kesselheim,Ben Rome和Anjali Deshmukh指出,乔·拜登总统于2022年12月签署综合支出法案的2023年综合拨款法案包括加速批准改革,例如授予FDA更大的权力,以确保在批准前进行;要求制造商每6个月进行进度报告一次;以及在后续试验没有发现临床效益时明确退出程序。重要的是要监测这些变化是否会导致更少的延迟,或者是否需要额外的授权,以确保验证性试验及时完成,以实现患者的利益。
耶鲁大学教授Joseph Ross和Reshma Ramachandran以及康涅狄格大学教授Karina Berg发表在The New England Journal of Medicine上的文章“Ensuring Public Trust in an Empowered FDA”也试图对加速批准进行权衡。随着综合法案中通过的改革,确实非常清楚地概述了撤回加速批准的步骤,但在征求公众意见方面给予了发起人自由裁决权。所以FDA仍然需要制定和公布潜在加速批准撤回流程的标准。例如,如果上市后要求延迟但仍在进行中,或者如果主要终点失败而次要终点是积极的,FDA会撤回产品吗?
David J Benjamin和Mark P Lythgoe教授在Oncologyvol上发表的“Modernising the US FDA's Accelerated Approval pathway”也对FDA加速批准的改革给出了多方面建议。
第一,新的改革应确保在授予加速批准之前进行批准后的研究,并扩大FDA可用的快速撤回程序。
第二,关键改革旨在提高通过加速审批的药物的公开性和透明度。申请者将被要求每180天向FDA提交进度报告,详细说明其确认性试验的进展情况,直到研究完成或终止。信息将通过FDA网站在公共领域提供,允许外部审查。
第三.关键改革授权成立加速批准委员会,由FDA高级官员组成,每年至少召开三次会议,讨论与加速批准有关的问题,并可能根据出现的问题实施进一步的改革。
第四,值得注意的是,改革要求FDA在决定不要求加速批准药物的验证性研究时,必须公布“[批准后研究]不合适或不必要的理由”。这项改革应该为这些批准后的决定提供更大的透明度和审查。
图3 the lancet oncology:加速批准政策的改革将为更多患者带来益处
虽然加速批准途径的改革是值得欢迎的,但目前仍不清楚这些变化是否最终能提供更清晰的指导,以及政策的执行是否能确保所有实体得到平等对待。考虑到FDA在早期批准新的癌症药物方面所发挥的关键性全球作用(例如,监管依赖),当务之急是通过改革来改善病人的结果。
参考资料:
1.中国食品药品网
2.https://endpts.com/more-than-half-of-accelerated-approval-confirmatory-trials-are-late-researchers-write-in-jama/
3.Deshmukh, Anjali D et al. “Timing of Confirmatory Trials for Drugs Granted Accelerated Approval Based on Surrogate Measures From 2012 to 2021.” JAMA health forum vol. 4,3 e230217. 3 Mar. 2023, doi:10.1001/jamahealthforum.2023.0217
4.Fashoyin-Aje, Lola A et al. “The On- and Off-Ramps of Oncology Accelerated Approval.” The New England journal of medicine vol. 387,16 (2022): 1439-1442. doi:10.1056/NEJMp2208954
5.Ross, Joseph S et al. “Ensuring Public Trust in an Empowered FDA.” The New England journal of medicine vol. 388,14 (2023): 1249-1251. doi:10.1056/NEJMp2300438
6.Benjamin, David J, and Mark P Lythgoe. “Modernising the US FDA's Accelerated Approval pathway.” The Lancet. Oncology vol. 24,3 (2023): 203-205. doi:10.1016/S1470-2045(23)00020-7
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..