国产PD-1特瑞普利单抗的出海之路,几经波折,终于即将迎来大结局。
日前,君实生物的海外PD-1合作方Coherus BioSciences,Inc.(下文简称Coherus)宣布,美国FDA已经成功完成了对特瑞普利单抗的批准前现场检查。

对特瑞普利单抗中国生产基地进行检查,是FDA对该药物用于治疗鼻咽癌BLA(生物制品许可申请)审查程序的前置条件。
公告中指出,FDA对其中三项检查结果进行了标记,并向企业签发了“483表格”,需要企业方回应。Coherus认为这三条意见容易解决,问题不大,计划与君实生物一同在6月初向FDA提交答复。
不过,资本市场显然很在意FDA的三条意见,消息一出,Coherus股价快速下跌又上涨,而君实生物的股价依然走弱。
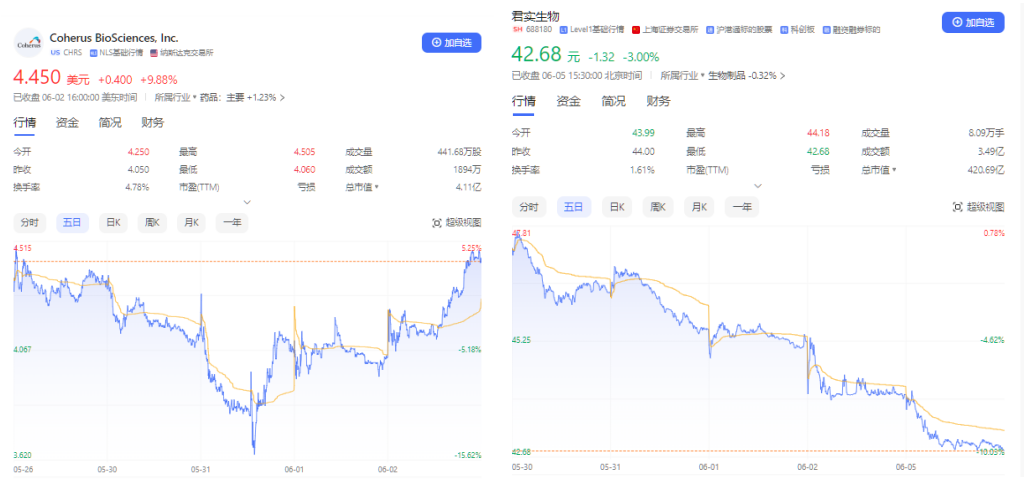
近几年,国内PD-1赛道内卷严重,君实生物无论是销售表现、适应症拓展,还是资本市场股价,都没有能够令投资者满意。随着国内PD-1单抗市场的天花板效应、红海市场逐渐浮现,创新药企纷纷将目光投向海外。
投资者认为,美国FDA的监管审批结果仅仅是产品国际化的一个阶段,未来产品在海外市场的商业化表现,依然取决于长期的临床推广和开发;特瑞普利单抗如果此次能够顺利获批,君实生物将有望迎来新的业绩增长点,但能否彻底逆转目前的市场颓势,依然有待长期的市场观察。
特瑞普利单抗国际化
如何踢好“临门一脚”?
按照Coherus的描述,美国FDA给出了“三条容易解决的意见”,从目前的进展情况来看,君实PD-1特瑞普利单抗距离美国FDA获批似乎只差“临门一脚”。
特瑞普利单抗是君实生物首个商业化的产品,是一种PD-1抑制剂,君实生物对其寄予厚望,在中国、美国、东南亚和欧洲等地累计开展了覆盖超过15个适应症的30多项临床研究,涉及肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等适应症。
早在2021年2月,君实生物就开始考虑出海,与Coherus公司就特瑞普利单抗在美国和加拿大的开发和商业化达成合作,并于当年3月正式向FDA滚动提交了特瑞普利单抗用于治疗复发或转移性鼻咽癌的BLA并获得了FDA滚动审评。
两年来,因种种原因,FDA对特瑞普利单抗的上市申请流程一次又一次的延期。
2022年7月FDA发布了一封完整回复函(CRL),要求君实生物进行一项较容易完成的质控流程变更,后又再次向FDA申报上市。受新冠疫情影响,FDA在当前审评周期内无法进行现场核查,上市申请审批进程在2022年12月再次延期。
本次BLA主要是基于POLARIS-02(一项多中心、开放标签、II期关键注册临床研究)及JUPITER-02(一项随机、双盲、安慰剂对照、国际多中心III期临床研究)的研究结果。
POLARIS-02研究中,190位既往接受过二线及以上系统治疗失败的复发或转移性鼻咽癌患者接受了特瑞普利单抗单药治疗,在总体人群中观察到5例完全缓解,34例部分缓解和40例疾病稳定患者,ORR为20.5%,达到主要研究终点。
2021年1月26日,POLARIS-02的临床研究成果在线发表于国际著名期刊《临床肿瘤学杂志》(Journal of Clinical Oncology)。POLARIS-02研究结果显示,特瑞普利单抗表现出持久的抗肿瘤活性和生存获益,安全性可控,且无论患者PD-L1表达如何,均可获益。
JUPITER-02研究中,289例未接受过化疗的RM-NPC患者按照1∶1的比例被分配至特瑞普利单抗(240mg,Q3W)联合GP化疗(吉西他滨和顺铂)组(n=146)或安慰剂联合GP化疗组(n=143)接受治疗,最多6个周期后,继续分别接受特瑞普利单抗(Q3W)或安慰剂单药维持治疗,直至出现疾病进展、或出现无法耐受的毒性、撤回知情同意或治疗已达2年。
研究结果显示,对于未接受过系统性治疗的复发或转移性NPC患者,与安慰剂联合化疗组相比,特瑞普利单抗联合化疗组中位无进展生存期(PFS)显著延长,为21.4vs.8.2个月,延长13.2个月,并且特瑞普利单抗联合化疗可降低48%的疾病进展或死亡风险(HR=0.52,95%CI:0.37-0.73,双侧p<0.0001)。
鼻咽癌的患者群体主要是亚洲人,在美国属于罕见癌种,在监管审批上有优势。同时,由于美国尚无药物获批用于鼻咽癌的治疗,特瑞普利单抗治疗鼻咽癌适应症的BLA符合“未被满足的临床需求”条件。业内人士指出,君实生物试图通过占领小适应症市场从而“开启快速上市通道”。
Coherus此前预计,特瑞普利单抗将于2023年第三季度在美国获得FDA的批准和商业上市。
业界也预测,今年有望成为国产PD-1真正的“出海”元年。
细分市场“内卷”
君实生物能否迎来转机?
君实生物成立于2012年12月底,其中核心产品,正是国内最早获批上市的特瑞普利单抗。不过,特瑞普利单抗自上市以来,商业化之路并非一帆风顺,先是从2020年的10.03亿元高峰腰斩为2021年的4.12亿元,2022年又回升至7.36亿元,销售量同比增长45%。
2020年底,君实由董事长熊俊带队、副总裁陈巍参与,以很低的价格谈判进入医保目录。在2021年3月正式列入2020年《国家医保目录》后,240mg(6ml)的特瑞普利单抗价格由最初的7200元/瓶下调至2100.97元/瓶,同比下降70.8%。在2021年年末,特瑞普利单抗入选2021年版药品目录后,再次降价8.9%,降到1912.96元。
然而,降价纳入医保后,君实生物却没有能够实现大幅度的“以价换量”。
今年5月31日,君实生物副总裁陈巍在朋友圈官宣离职。陈巍曾数次带队出现在国家医保谈判现场,全程负责了重磅产品PD-1特瑞普利单抗从2020年到2022年的医保谈判。业内人士猜测,陈巍离职,与君实生物产品的准入不利有很大的关系。
按照公司公告,2021全年特瑞普利单抗实现销售收入人民币4.12亿元,同比下降将近60%,除了有纳入医保后价格下降的原因以外,君实生物还在特瑞普利单抗降价后对经销商的全部库存进行了差价补偿。
2021年是君实商业化团队较为动荡的一年。公开信息显示,2021年以来,多位负责PD-1商业化的君实高管相继离职,公司团队先后经历了几轮商业化负责人及内部营销人员的调整。
一番调整过后,公司商业化能力提升,加之特瑞普利单抗新增2项大适应症获批,2022年,特瑞普利单抗销售量比同比增加45.31%,药品销售收入也同步增加,国内市场的销售情况正向改善。
君实生物在公告中强调,随着临床研究的加速,特瑞普利单抗越来越多一线治疗、围手术期治疗及术后辅助治疗领域的关键注册临床陆续揭盲,更多新适应症进入sNDA阶段。截至目前,特瑞普利单抗在中国获批6项适应症,其中3种适应症纳入医保。
然而,在君实生物、信达生物、恒瑞医药、百济神州这四家头部企业中,君实生物获批适应症数量目前最少,从2022年国内PD-(L)1市场份额(不包括卡瑞利珠单抗)来看,拥有先发优势的特瑞普利单抗业绩表现也并没有能够满足资本市场的期待。相比之下,百济神州的替雷利珠单抗的逆袭,分别在2020年和2022年赶超特瑞普利单抗和信达生物的信迪利单抗,以超过4.23亿美元销售额和11项获批适应症处于领先位置。除此之外,康方生物、复宏汉霖、康宁杰瑞/思路迪/先声药业等后来者也在细分领域虎视眈眈。
面对国内的“内卷”压力,国际化已经成为一个必选项。除美国外,君实生物还把出海目标转向中东、北非地区。2022年12月25日,君实生物发布公告:与Hikma制药达成许可与商业化合作,将在沙特阿拉伯、阿联酋、卡塔尔、约旦、摩洛哥、埃及等中东和北非地区共20个国家对特瑞普利单抗进行开发和商业化。
今年3月28日,君实官宣与康联达(Rxilient,康哲药业控股)合作,设立合资公司一起在东南亚九国开发、商业化特瑞普利单抗。这是继君实和Coherus、Hikma签订北美、中东和北非合作之后又一个新的动作。
业内人士指出,鼻咽癌在美国是一个“小癌种”,细分市场并不大,但在获得美国FDA审批之后,以澳大利亚、新加坡等国家为代表的监管机构,同样认可FDA的监管信息;“以小适应症开启上市通道”对于快速辐射海外市场,是一个比较稳妥的选择。
十年来,君实生物始终被亏损的阴影笼罩。如今,特瑞普利单抗的国际化进展能否逆转君实生物在国内市场颓势,让我们拭目以待。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..