根据PDUFA的预期目标日期,预计6月,美国FDA将对8款创新药物的批准做出监管决定。
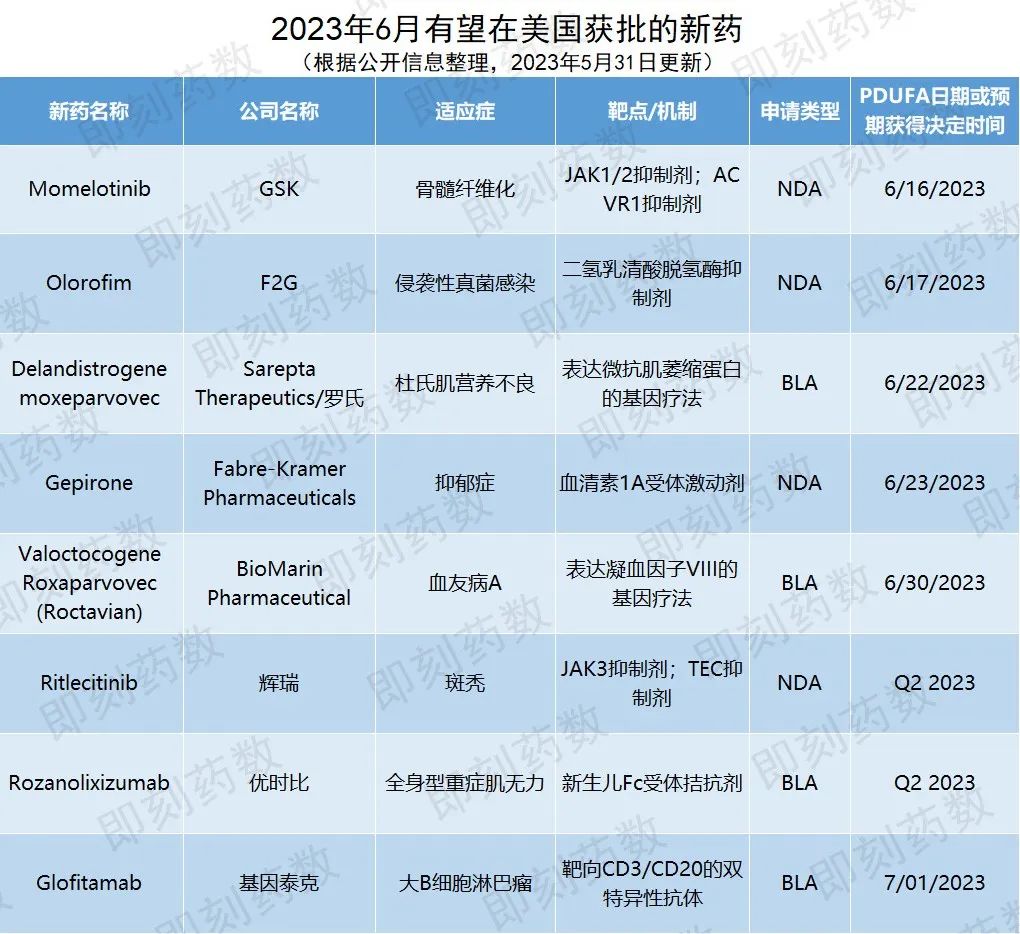
▲6月有望在美国获批的新药(药明康德内容团队制图,点击可见大图)
药物名称:Momelotinib
公司名称:GSK
适应症:骨髓纤维化
Momelotinib具有独特的作用机制,可抑制三条关键信号通路:激活素A受体I型(ACVR1)、JAK1和JAK2。骨髓纤维化是一种由JAK-STAT信号异常导致的罕见血液肿瘤,其症状特征包括脾脏肿大、进行性贫血和其它全身性症状。
在治疗骨髓纤维化患者的一项关键性3期临床试验中,momelotinib达到所有主要和关键次要终点。治疗24周时,momelotinib组达到总体症状评分(TSS)较基线改善超过50%的患者比例为25%,对照组这一数值为9%。24周时不依赖输血的患者比例:momelotinib组为31%,对照组为20%;脾脏体积减少超过35%的患者比例:momelotinib组为23%,对照组为3%。这表明momelotinib在缓解症状、脾脏应答和控制贫血方面较对照组具有统计学显著性的改善,且这一改善具有临床价值。
Sierra Oncology于去年6月向美国FDA递交momelotinib治疗骨髓纤维化的新药申请(NDA)。在去年7月,GSK宣布完成对Sierra Oncology公司的收购。获得这款在研疗法的开发权益。
药物名称:olorofim
公司名称:F2G
适应症:侵袭性真菌感染
Olorofim是F2G开发的一种新型口服抗真菌药物,用于治疗难治性侵袭性真菌和霉菌感染。Olorofim不同于现有的抗真菌药物,通过抑制嘧啶合成途径发挥杀菌活性。F2G公司表示,olorofim代表过去20年来开发的首个创新抗真菌药物类型,它也是首个获得美国FDA授予突破性疗法认定,针对多重适应症的抗真菌药物。
Olorofim的NDA得到2b期开放标签临床研究中前100名患者的良好疗效和安全性数据的支持。这些患者的侵袭性真菌感染治疗选择有限。在接受治疗42天时,44%的患者获得完全或部分缓解。包括疾病稳定患者,总体应答率为69%。
药物名称:Delandistrogene moxeparvovec
公司名称:Sarepta Therapeutics、罗氏
适应症:杜氏肌营养不良(DMD)
Sarepta Therapeutics公司与罗氏联合开发的delandistrogene moxeparvovec是一种基因疗法,旨在将编码微抗肌萎缩蛋白(micro-dystrophin)的转基因递送到肌肉组织以替代抗肌萎缩蛋白的主要功能。DMD是一项罕见的X-染色体连锁遗传疾病,是由于在X染色体上编码抗肌萎缩蛋白的基因出现突变而导致,因此几乎只影响男性患者,是最常见的儿童神经肌肉疾病之一。DMD患者会逐步丧失步行与进食能力,预期寿命通常不超过40岁。
FDA于2022年11月受理了该药物的生物制品许可申请(BLA)并授予其优先审评资格。这一BLA申请是基于在临床前研究、生物标志物研究和临床功能研究所取得的积极结果。5月12日,在美国FDA召开的咨询会议上,与会专家以8:6非常微弱的优势,投票支持这款基因疗法通过加速批准通道上市。5月24日,Sarepta Therapeutics公司宣布,FDA需要更多时间完成对BLA的审评,预计将在6月22日之前做出审评决定。
药物名称:Gepirone
公司名称:Fabre-Kramer Pharmaceuticals
适应症:抑郁症
Gepirone是Fabre-Kramer公司开发的一款创新口服血清素(5HT)1A受体激动剂,用于治疗抑郁症(MDD)和其它心理障碍。抑郁症是最常见的精神疾病之一,全球约2.8亿患者。与此同时,近2/3抑郁症患者无法从现有疗法中获得充分缓解。
Gepirone治疗MDD的疗效获得两项随机双盲,含安慰剂对照的关键性临床试验的支持。在两项研究中,根据汉密尔顿抑郁量表(HAMD-17)的评估结果,gepirone与安慰剂相比,显著改善患者的HAMD-17总分。具体数据请见下表。
药物名称:Valoctocogene Roxaparvovec(Roctavian)
公司名称:BioMarin Pharmaceutical
适应症:血友病A
BioMarin Pharmaceutical公司开发的valoctocogene roxaparvovec是一款使用AAV5病毒载体递送表达凝血因子VIII转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达因子VIII,从而不再需要长期接受预防性凝血因子注射。血友病A以反复出血及其相关并发症为主要临床表现,其中约80%为关节出血,其并发症主要是慢性出血性关节病变。目前,血友病A的主要治疗手段是定期输注凝血因子VIII,但频繁的输注给患者的生活带来了极大不便。
FDA于2022年10月接收了关于该药物重新递交的生物制品许可申请。此次递交结合了BioMarin Pharmaceutical公司对之前FDA在2020年8月18日所发的完全回应信函(CRL)的回应,并包含GENEr8-1临床3期试验的2年结果,以及临床1/2期试验的5年追踪支持数据。GENEr8-1试验结果显示,valoctocogene roxaparvovec能够稳定和持久地控制出血。与入组前一年的数据相比,单次输注valoctocogene roxaparvovec后,患者的凝血因子VIII使用率和需要接受治疗的年化出血率分别降低了99%和84%(p<0.001)。今年1月的更新临床试验数据显示,在接受治疗第三年后,患者的平均年化出血率减少了80%,而凝血因子VIII的使用减少了94%。
药物名称:Ritlecitinib
公司名称:辉瑞
适应症:斑秃
Ritlecitinib是辉瑞开发的一种一天一次的新型口服共价双激酶抑制剂,它对JAK3激酶以及在TEC家族中的酪氨酸激酶具高度选择性。此药物可通过抑制造成脱发的免疫细胞内信号通路来达到治疗斑秃的效果。Ritlecitinib在2018年9月获得美国FDA的突破性疗法认定用以治疗斑秃。
去年9月,辉瑞宣布美国FDA和欧洲药品管理局(EMA)接受了ritlecitinib用于治疗12岁以上斑秃患者的监管申请。这一新药申请是基于此前公布的ALLEGRO临床2b/3试验,以及开放标签3期临床试验ALLEGRO-LT的结果。在ALLEGRO试验中,治疗24周后,接受30 mg或50 mg ritlecitinib治疗的患者(伴或不伴先接受4周每日一次200 mg ritlecitinib的初始治疗),头皮脱发≤20%的患者比例显著高于安慰剂组。
药物名称:Rozanolixizumab
公司名称:优时比(UCB)
适应症:全身性重症肌无力(gMG)
Rozanolixizumab是一款具高亲和性、皮下注射、靶向人类胎儿Fc受体(FcRn)的人源化单克隆抗体。通过阻断FcRn与免疫球蛋白G(IgG)的相互作用,rozanolixizumab可加速抗体代谢,减少体内致病的IgG自身抗体浓度。此在研药品分别于2019与2020年获得FDA与欧盟授予的孤儿药资格,用以治疗重症肌无力。
今年1月,优时比宣布FDA已接受rozanolixizumab的BLA并授予其优先审评资格。这一申请主要基于MycarinG关键性3期临床试验的结果。试验达到主要终点,在带有AChR、MuSK抗体的重症肌无力患者中,rozanolixizumab显著减缓患者自基线至第43天期间的重症肌无力日常活动度(MG-ADL)分数。
药物名称:Glofitamab
公司名称:基因泰克
适应症:大B细胞淋巴瘤
Glofitamab是一款能够同时靶向CD3与CD20的双特异性抗体。这一双特异性T细胞衔接抗体具创新的2:1结构形式,包含一个靶向T细胞表面CD3蛋白的蛋白域和两个与B细胞表面CD20蛋白结合的蛋白域,此双重靶向策略可使T细胞接近B细胞,并激活T细胞以毒杀癌细胞。
今年1月,基因泰克宣布美国FDA已经接受glofitamab的生物制品许可申请并授予其优先审评资格。用于治疗复发/难治性大B细胞淋巴瘤(r/r LBCL)成人患者,这些患者曾接受过2线以上的系统性治疗。这一BLA主要基于关键性1/2期试验NP30179的积极结果。在中位随访时间为13.4个月时,40.0%的病患(n=62/155)获得完全缓解(CR),51.6%患者(n=80/155)获得客观缓解(包含达成完全缓解与部分缓解的患者)
参考资料:
[1] Sarepta Therapeutics Announces Update on Regulatory Review of SRP-9001. Retrieved May 31, 2023, from https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-announces-update-regulatory-review-srp-9001?_ga=2.236044417.1065370343.1685550232-1010067830.1685550232
[2] F2G Announces FDA Filing Acceptance of New Drug Application for Olorofim for the Treatment of Invasive Fungal Infections. Retrieved May 31, 2023, from https://www.f2g.com/press_releases
[3] Submission of EXXUA (gepirone HCl), a novel targeted single serotonin receptor agonist for treatment of Major Depressive Disorder receives PDUFA action date of June 23, 2023. Retrieved May 31, 2023, from https://fabrekramer.com/fabre-kramer-pharmaceuticals-announces-fda-acceptance-of-nda-resubmission-as-complete-response-and-assignment-of-pdufa-regulatory-action-date/
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..