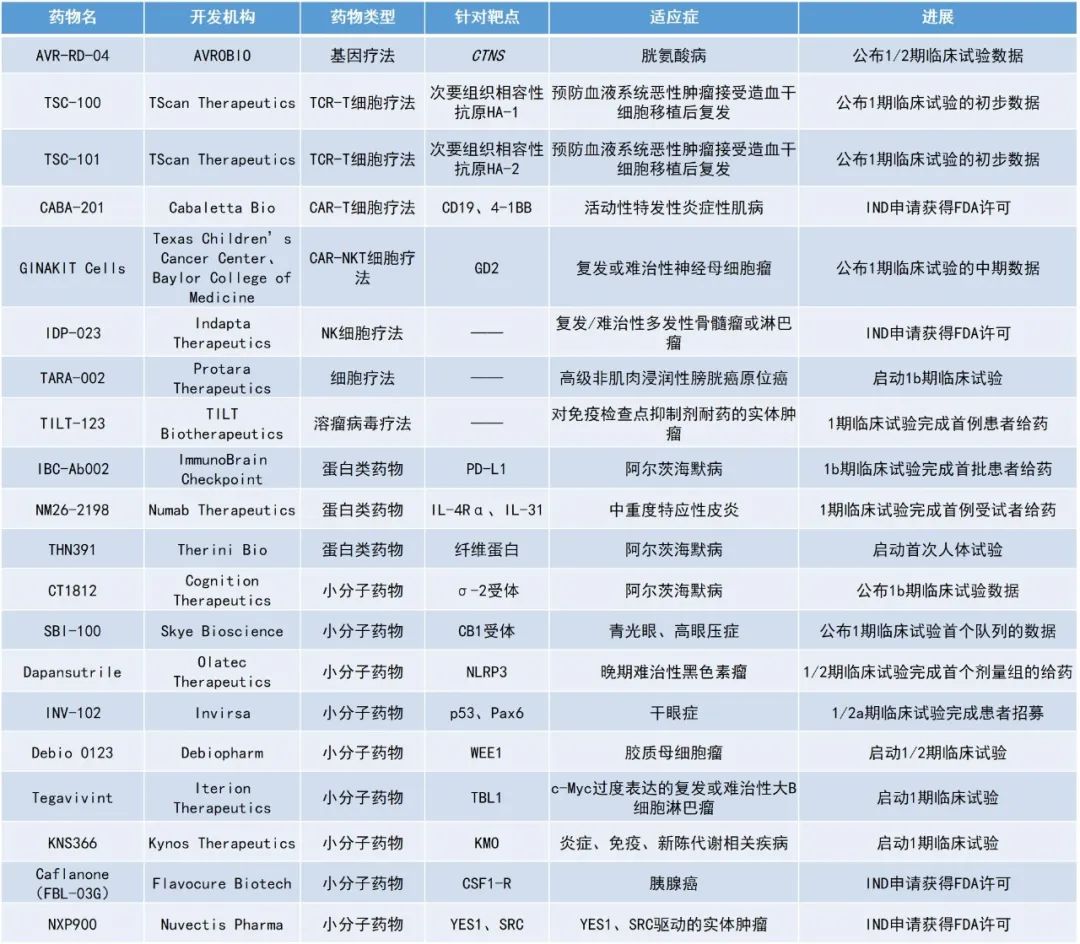
1. 治疗阿尔茨海默病的小分子疗法CT1812取得首个人体试验积极结果,可迅速从神经突触中的驱除β淀粉样蛋白(Aβ)寡聚体,保护神经突触。
2. TScan Therapeutics公布了其开发的两种T细胞受体(TCR)工程化T细胞疗法TSC-100和TSC-101的早期临床数据,展现出预防血液系统恶性肿瘤患者接受造血干细胞移植后复发的潜力。
3. 用于治疗胱氨酸病(cystinosis)的在研基因疗法AVR-RD-04早期数据亮眼,患者已无需口服治疗药物长达三年。
药明康德内容团队整理
CT1812:公布1b期临床试验数据
Cognition Therapeutics公司公布了其候选疗法CT1812用于治疗阿尔茨海默病的1b期临床试验的积极结果。CT1812是一种旨在穿透血脑屏障的口服小分子,能够选择性地结合σ-2受体复合物。σ-2受体复合物参与了一些关键的细胞过程,例如膜运输和自噬的调节,这些过程会因与可溶性Aβ寡聚体、氧化应激和其他应激源的毒性相互作用而受损。CT1812有望通过影响Aβ寡聚体与神经突触上受体的结合,加速其从受体上清除至脑脊液(CSF)的速率,从而保护神经突触免受Aβ寡聚体触发的神经毒性级联反应,改善阿尔茨海默病患者的认知能力。
临床前研究显示,在单次给予CT1812后,小鼠CSF中的Aβ寡聚体水平有所增加,并且CT1812对Aβ寡聚体的驱除能够恢复突触功能,这在临床前阿尔茨海默病模型中与认知功能的改善有关。此次公布的结果显示,3名患者单次口服CT1812可导致患者CSF中的Aβ寡聚体水平显著增加,这表明其神经突触中的Aβ寡聚体被迅速驱除。而使用安慰剂时,患者CSF中的Aβ寡聚体水平没有变化。此外,CT1812耐受性良好,没有与研究药物相关的严重不良事件。
相关阅读:再战阿尔茨海默病,这种小分子药物能否力挽狂澜?
TSC-100、TSC-101:公布1期临床试验的初步数据
TScan Therapeutics公布了其开发的两种TCR-T细胞疗法TSC-100和TSC-101的早期临床数据。TSC-100和TSC-101分别表达针对次要组织相容性抗原(MiHAs)HA-1和HA-2的TCR,两者均由HLA-A*02:01呈递。这两种候选疗法均针对接受减弱强度预处理(RIC)的同种异体半相合造血干细胞移植(HCT)的急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)和骨髓增生异常综合症(MDS)患者,旨在消除移植后持续存在的所有受体造血细胞,包括恶性细胞,同时不影响供体来源的细胞,从而预防疾病复发。这类患者中约有42%的人会在移植后的两年内复发,此时治疗选择有限且预后不良。
此次公布的结果显示,1名具有p53突变的高风险MDS患者在移植后21天时给予剂量水平(DL)1的TSC-101,TSC-101细胞在接受给药后的14-21天表现出扩增,并被观察到可检测的活化和增殖标志物。接受治疗21天后,供体嵌合度为100%(即检测不到患者来源的造血细胞,灵敏度检测限为0.13%);微小残留病(MRD)评估显示,移植后骨髓和外周血样本中未检测到p53突变(灵敏度检测限为0.01%)。研究人员计划将剂量推进至DL2。1名T细胞ALL患者在移植后28天时接受了DL1的TSC-100。研究人员在给药第7天检测到了T细胞的扩增,并观察到可检测的T细胞活化和增殖标志物。相比之下,两名仅接受了HCT的对照组患者均在移植后发生了不完全的供体嵌合体(即存在患者来源的细胞)。其中1名患者在移植100天后观察到了患者来源的细胞仍在增加,表明其已处于复发早期。此外,尚未观察到两种候选疗法的剂量限制性毒性。
AVR-RD-04:公布1/2期临床试验的初步数据
AVROBIO公司公布了其用于治疗胱氨酸病的在研基因疗法AVR-RD-04的1/2期临床试验数据。胱氨酸病是一种罕见的进行性疾病,其特征是胱氨酸在溶酶体中积累,从而导致进行性的器官损伤、角膜损伤、吞咽功能障碍、导致终末期肾病的慢性肾病和导致寿命缩短的肌肉萎缩。目前,超过90%接受治疗的胱氨酸病患者在20-30岁时需要进行肾移植。该病目前的标准治疗药物是半胱胺,这种治疗方案每天可能需要服用数十颗药片,但它不能阻止整体疾病进展,并且会带来难以忍受的副作用,例如呼吸和身体产生气味以及胃肠道并发症。
AVR-RD-04是一种通过对患者自身的造血干细胞(HSC)进行基因改造,使其表达在胱氨酸病患者中缺乏的功能性胱氨酸蛋白酶的基因疗法。在这项研究中,患者接受基因疗法后全身(包括眼睛、皮肤和胃肠道粘膜在内的多种组织)均检测到了功能性胱氨酸蛋白酶。该基因疗法可持久和系统地影响神经认知标志物,目前所有接受治疗的患者(6名)血液中的白细胞胱氨酸水平降至基线以下,已维持36个月不需要口服半胱胺。此外,皮肤和胃肠道粘膜活检显示,前4名患者的组织胱氨酸晶体同样下降至基线以下,这些患者已被观察了至少12个月,其中2名患者的观察时间已长达24个月。
GINAKIT Cells:公布1期临床试验的中期数据
贝勒医学院(Baylor College of Medicine)、得克萨斯儿童癌症中心(Texas Children’s Cancer Center)及其合作机构的研究人员报告了一项首次在人体中进行的1期临床试验的中期结果。该试验评估了一种针对神经母细胞瘤(一种最常在肾上腺出现的儿童肿瘤)的基因工程化天然杀伤性T细胞(NKT)免疫疗法GINAKIT Cells的安全性、抗肿瘤活性和免疫特性。该NKT细胞被修饰以共表达GD2特异性嵌合抗原受体(GD2 CAR)以及白细胞介素-15(IL-15,一种支持NKT细胞存活的天然蛋白)。其中,GD2 CAR使得免疫细胞能够靶向神经母细胞瘤细胞表面的分子。
此次公布的结果显示,该治疗方法的耐受性良好,没有报道剂量限制性毒性。12名接受治疗的患者中,3名患者对治疗表现出客观缓解,包括1名完全缓解和2名部分缓解。在另外2名患者身上,该NKT细胞疗法也表现出了抗肿瘤活性,例如能够清除骨髓受累或减少转移性肿瘤负荷,但他们尚未达到部分缓解的标准。
CABA-201:IND申请获得FDA许可
CABA-201是Cabaletta Bio开发的含4-1BB的全人源CD19 CAR-T细胞候选疗法,于近期获得了FDA批准的第二项IND申请,用于治疗活动性特发性炎症性肌病。活动性特发性炎症性肌病包括一系列以炎症和肌肉无力为特征的自身免疫性疾病。在某些情况下,该病还可能影响身体的其他器官和系统,如肺、心脏或皮肤。CABA-201是一种一次性输注的CAR-T细胞疗法,具有暂时完全消除B细胞的潜力,有望为CABA-201自身免疫性疾病患者提供深度和持久的治疗方法。此前,CABA-201已获得FDA批准的针对系统性红斑狼疮(SLE)的首个IND申请。
IDP-023:IND申请获得FDA许可
IDP-023是Indapta Therapeutics公司开发用于治疗癌症的同种异体自然杀伤(NK)细胞疗法,于近期获得了FDA批准的IND申请,用于治疗多发性骨髓瘤和淋巴瘤患者。该公司开发了同种异体FcεRIγ缺陷型NK细胞,称为G-NK细胞,并致力于将这种现货型细胞疗法带给患者,以解决目前可用的自体T细胞疗法的局限性。Indapta公司的通用同种异体G-NK细胞治疗平台旨在显著提高单克隆抗体疗法在多种类型癌症中的抗癌能力。与传统NK细胞相比,G-NK细胞在临床前研究中显示出更有效和持久的抗肿瘤活性,且无需基因工程改造。
SBI-100:公布1期临床试验首个队列的数据
Skye Bioscience公司公布了其眼用乳剂(OE)SBI-100用于治疗青光眼和眼压增高的1期临床试验的首个队列的数据。Skye Bioscience旨在通过开发其专有的大麻素衍生物来释放大麻素的潜力,从而治疗具有重大未竟需求的疾病。SBI-100 OE采用新型分子结构和纳米乳剂配方,使其中的有效成分CB1R激动剂可更好地穿透眼内组织,实现有效的局部给药,对降低眼内压具有良好的疗效。此次公布的数据显示,SBI-100 OE耐受性良好,没有与药物相关的严重不良事件,只有轻度和中度不良事件。报告的不良事件与局部应用的眼部治疗一致。
NXP900:IND申请获得FDA许可
NXP900是Nuvectis Pharma公司开发的一种在研新型SRC/YES1激酶抑制剂,其IND申请已获得美国FDA的许可。SRC在许多癌症类型中异常激活,其活性增加通常与癌症进展、癌细胞转移和治疗耐药性产生相关,并与不良临床预后相关。临床前研究显示,NXP900能够在浓度<0.5 nM时抑制SRC和YES1激酶的活性,并以其独特的作用机制导致SRC通路失活,有望治疗SRC和YES1驱动的实体肿瘤。
Caflanone(FBL-03G):IND申请获得FDA许可
Caflanone(FBL-03G)是Flavocure Biotech公司开发的候选疗法,其IND申请已获得美国FDA的许可。该公司即将启动FBL-03G联合放疗治疗胰腺癌的1期人体临床试验。FBL-03G是一种黄酮类化合物,是大麻代谢产物cannflavin B的非天然异构体,但不是大麻类物质。FBL-03G能够通过抑制CSF1-R靶向肿瘤相关巨噬细胞,同时还显示出对胰腺癌和许多其他肿瘤中的主要突变KRAS表达的强烈抑制作用。胰腺癌患者中KRAS G12D突变的频率超过36%,FBL-03G已被证明可抑制这种难以治疗的癌症基因的基因表达。除胰腺癌外,FBL-03G已在多种癌症中表现出活性,包括胶质母细胞瘤(最具侵袭性的脑癌)、急性髓系白血病和多发性骨髓瘤。2019年,FBL-03G获得了FDA授予的孤儿药资格,用于治疗胰腺癌。
参考资料:
[1] Nuvectis Pharma Announces FDA Clearance of NXP900 IND. Retrieved May 16, 2023, from https://www.globenewswire.com/news-release/2023/05/15/2668709/0/en/Nuvectis-Pharma-Announces-FDA-Clearance-of-NXP900-IND.html
[2] Invirsa Completes Enrollment of Phase 1/2a Dry Eye Study . Retrieved May 16, 2023, from https://www.businesswire.com/news/home/20230515005537/en
[3] Therini Bio Initiates First-In-Human Dosing in Phase 1 Trial of THN391, a Fibrin-Targeting Therapeutic Candidate for Alzheimer’s Disease. Retrieved May 16, 2023, from https://www.businesswire.com/news/home/20230515005293/en/
[4] Protara Therapeutics Announces Dosing of First Patients in Phase 1b ADVANCED-1EXP Trial of TARA-002 in NMIBC Patients with Carcinoma in Situ. Retrieved May 16, 2023, from https://ir.protaratx.com/news-releases/news-release-details/protara-therapeutics-announces-dosing-first-patients-phase-1b
[5] Numab Therapeutics Announces First Subject Dosed in Phase 1 Clinical Study of NM26 Program. Retrieved May 16, 2023, from https://www.businesswire.com/news/home/20230514005072/en/
[6] TILT Biotherapeutics Announces First Patient Dosed in Phase I Solid Tumors Trial Assessing Oncolytic Adenovirus TILT-123 in Combination with Checkpoint Inhibitor. Retrieved May 16, 2023, from https://tiltbio.com/userassets/uploads/2023/05/T776-Press-release-May-2023.pdf
[7] Cabaletta Bio Receives FDA Clearance of IND Application for CABA-201 for Treatment of Myositis. Retrieved May 17, 2023, from https://www.globenewswire.com/news-release/2023/05/16/2669808/0/en/Cabaletta-Bio-Receives-FDA-Clearance-of-IND-Application-for-CABA-201-for-Treatment-of-Myositis.html
[8] Olatec Therapeutics Announces the Completion of First Dose Cohort in an Innovative Trial Investigating Olatec’s NLRP3 Inhibitor Dapansutrile and Merck’s Keytruda® in Patients with Advanced Refractory Melanoma at Duke Cancer Institute. Retrieved May 17, 2023, from https://www.businesswire.com/news/home/20230516005286/en
[9] Iterion Therapeutics Announces the Initiation of a Phase 1 Clinical Trial for Tegavivint in Patients with c-Myc-overexpressing Relapsed or Refractory Large B-Cell Lymphomas. Retrieved May 17, 2023, from https://www.prnewswire.com/news-releases/iterion-therapeutics-announces-the-initiation-of-a-phase-1-clinical-trial-for-tegavivint-in-patients-with-c-myc-overexpressing-relapsed-or-refractory-large-b-cell-lymphomas-301825538.html
[10] ImmunoBrain Checkpoint Doses First Patients in Phase 1b Clinical Trial of IBC-Ab002 for Alzheimer's Disease. Retrieved May 18, 2023, from https://www.prnewswire.com/news-releases/immunobrain-checkpoint-doses-first-patients-in-phase-1b-clinical-trial-of-ibc-ab002-for-alzheimers-disease-301826238.html
[11] DEBIOPHARM LAUNCHES PHASE 1/2 COMBINATION TRIAL INVESTIGATING BRAIN-PENETRANT SELECTIVE WEE1 INHIBITOR FOR BRAIN CANCER PATIENTS. Retrieved May 18, 2023, from https://www.prnewswire.com/news-releases/debiopharm-launches-phase-12-combination-trial-investigating-brain-penetrant-selective-wee1-inhibitor-for-brain-cancer-patients-301826612.html
[12] Indapta Therapeutics Announces U.S. FDA Clearance of IND for IDP-023, an Allogeneic Natural Killer (NK) Cell Therapy for Cancer. Retrieved May 18, 2023, from https://www.businesswire.com/news/home/20230517005300/en/
[13] Flavocure Biotech Announces FDA Clearance of IND Application for Caflanone (FBL-03G), for Clinical Trials in Pancreatic Cancer Patients. Retrieved May 18, 2023, from https://www.newsfilecorp.com/release/166280
[14] Skye Bioscience Begins Dosing Fifth of Six Cohorts in Phase 1 Clinical Trial of Novel CB1R Agonist. Retrieved May 18, 2023, from https://www.newsfilecorp.com/release/166391
[15] TScan Therapeutics Presents Preliminary Phase 1 Clinical Results on TSC-100 and TSC-101 at the American Society of Gene & Cell Therapy 26th Annual Meeting. Retrieved May 18, 2023, from https://www.globenewswire.com/news-release/2023/05/17/2670856/0/en/TScan-Therapeutics-Presents-Preliminary-Phase-1-Clinical-Results-on-TSC-100-and-TSC-101-at-the-American-Society-of-Gene-Cell-Therapy-26th-Annual-Meeting.html
[16] AVROBIO Announces Positive Data from Phase 1/2 Clinical Trial of Investigational Gene Therapy for Cystinosis at the ASGCT 26th Annual Meeting. Retrieved May 18, 2023, from https://www.businesswire.com/news/home/20230518005344/en
[17] KYNOS THERAPEUTICS ANNOUNCES A FIRST-IN-HUMAN PHASE I STUDY OF ITS NOVEL SMALL MOLECULE KMO INHIBITOR, KNS366, IS UNDERWAY. Retrieved May 18, 2023, from https://www.kynostx.com/news/kynos-therapeutics-announces-a-first-in-human-phase
[18] Cognition Therapeutics Publishes Clinical Evidence that CT1812 Displaces Aβ Oligomers from Binding to Neuronal Synapses in Alzheimer’s Disease. Retrieved May 18, 2023, from https://ir.cogrx.com/news-releases/news-release-details/cognition-therapeutics-publishes-clinical-evidence-ct1812
[19] CAR-NKT cell therapy shows promising results against neuroblastoma in phase 1 clinical trial. Retrieved May 16, 2023, from https://www.eurekalert.org/news-releases/989301
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..