在杜氏肌营养不良症(DMD)患者中,DMD基因的突变破坏了肌营养不良蛋白的产生。大多数引起DMD的突变会导致一个或多个外显子从基因序列中删除。这反过来又会使突变后的遗传密码失去一致性。结果,细胞最终会产生一种较短的蛋白质,这种蛋白质会迅速降解。
可以通过跳过某些外显子来恢复肌营养不良蛋白的产生,从而使基因的其余部分能够被正确读取。
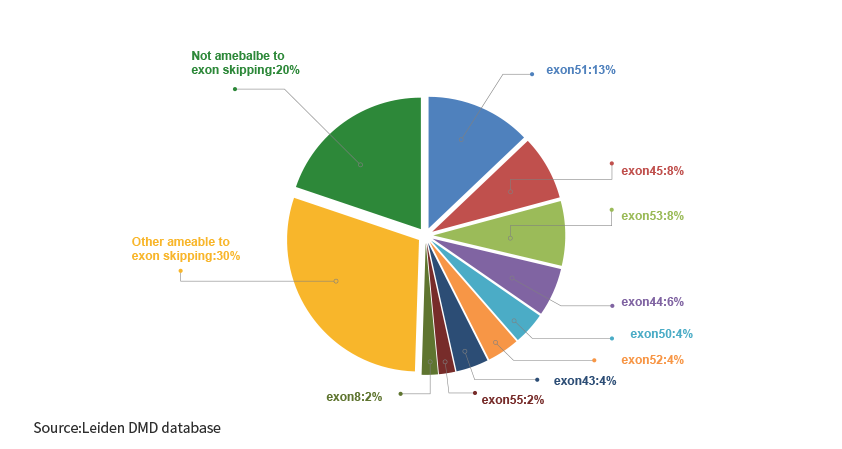
图 外显子跳跃可治疗的DMD突变
目前,经美国食品药品监督管理局(FDA)批准上市治疗杜氏肌营养不良症(DMD)外显子跳跃药物,主要是外显子跳跃包括45,51,53的反义寡核苷酸(ASO)药物。
与此同时,生物制药公司也在开发针对其他外显子跳跃的DMD药物,近日有2种药物已取得新进展:
中国公司开发的外显子50跳跃DMD药物Pre-IND申请获FDA受理
目前尚未有针对抗肌萎缩蛋白基因外显子50跳跃的药物在临床。
近日,作为最早进行体内碱基编辑药物开发公司之一,苏州新芽基因生物技术有限公司宣布首个碱基编辑产品GEN6050 向FDA提交pre-IND申请并被受理。
GEN6050是一款针对DMD外显子50跳跃可治疗的体内碱基编辑药物。旨在通过碱基编辑,达到DMD基因外显子50跳跃,恢复抗肌萎缩蛋白的表达。根据LEIDEN DMD数据显示外显子50跳跃可用于4%的大片段缺失DMD患者治疗。
FDA批准外显子44跳跃DMD药物II期研究计划
在与FDA达成协议后,NS Pharma将启动一项II期临床试验,以评估其研究性外显子44跳跃疗法NS-089/NCNP-02治疗DMD。
NS-089/NCNP-02是一种外显子跳跃疗法,旨在基本上跳过DMD基因的外显子44,产生比正常更短但具有功能的肌营养不良蛋白。
该疗法可使7%至11%的DMD患者受益,这些患者可跳过外显子44。
NS Pharma表示,一旦即将注册,试验细节将公布,但该研究的目标已经确定:评估该公司的候选治疗方案NS-089/NCNP-02对DMD的疗效。
NS-089/NCNP-02(NCT04129294)的I/II期试验在日本进行,于2022年5月完成,评估了6名DMD患者(均为男童)的肌营养不良蛋白水平和运动功能的变化。男童接受40 mg/kg(低剂量)或80 mg/kg(高剂量)的治疗,每周一次,持续24周,或约6个月。
结果显示,在接受低剂量治疗的患者中,肌营养不良蛋白水平平均增加到正常水平的10.27%,在接受高剂量治疗的病人中增加到正常的15.79%。
这6名参与者加入了该研究的扩展II期阶段部分(NCT05135663),该部分将继续评估低剂量和高剂量NS-089/NCNP-02的安全性、耐受性和有效性,每周输注一次持续约四年(216周)。这项研究预计将于2026年7月完成。
值得一提的是,NS Pharma的Viltepso(viltolarsen)在日本获得批准,在美国有条件地批准用于可跳过外显子53的DMD患者。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..