这周一,FDA公布了“使用创新的沟通方法来提高对“药品审评和研究中心(CDER)”指南的认知和理解:CDER 指南快照试点计划”。读过FDA指南的人恐怕都有过对整体用意和具体文字不甚明白的经历。FDA将为指南添加图文并茂的快照(snapshot),以便读者一目了然指南的内容、用途和来龙去脉,并配以播客重放和听记。
试点将先以下述两份指南起步:(1)“增强临床试验人群的多样性 - 资格标准、招募实践和试验设计”,及(2)“以患者为中心的药品开发指南 4:将临床结果评估纳入监管决策制定的终点”。这两份指南快照具体长成啥样子,尚不得而知,但可从FDA去年10月发布的一份指南快照中得到一些启发(其实,零星的快照早于 2018 年就有了,只是正式的试点计划刚开始)。如下面三张截图所示。
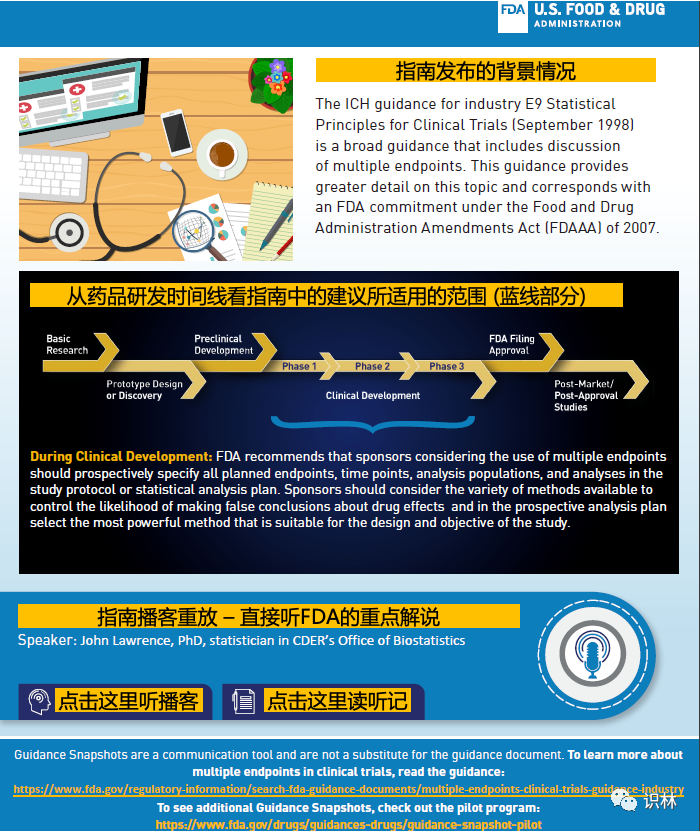


FDA的这项举措是为了落实于2010年生效的《简明文字法》(12年前?!),其目的是让所有联邦政府(不限于FDA)发布的公文易于公众理解和使用。请注意该法律中的如下三点:
(1) 各政府部局要在其官网上设“简明文字专栏”,说明其所作所为。并给出专人的姓名和联络方式,以便公众问询和提意见。部局一把手还要在专栏上公布在简明文字方面工作的年报。
(2) 规章(regulation)不受该法律管。规章本质上是行政法,其是否合法由法院解释。数百年的法律先例定义了行政法中字词和术语的含义,用通俗易懂的语言写规章会破坏法律先例的体系。
(3) 该法律不能作为法律质疑的理由,因为质疑只会使政府公文回到传统的官僚术语,以模糊其含义来声称质疑是对公文的错误理解。换句话说,这有助于确保以易懂的语言解释公文的善意努力不会被用作质疑解释不清的基础。
这三点揭示了《简明文字法》的特殊用心,即,用透明和公众监督的方式来督促而不是强制官僚机构做善事。这是因为政府部门都愿意有所作为,但又都怕由此而引发风险。
笔者感谢北京大学访问学者Garth Boehm博士就上述三点给出的深入见解。
作者:榆木疙瘩
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..