今日,Amicus Therapeutics公司宣布,欧盟委员会已经批准Pombiliti(cipaglucosidase alfa)上市,作为长效酶替代(ERT)疗法,与miglustat联用,治疗晚发型庞贝病成人患者。这是这款疗法在全球范围内首次获得监管机构的批准。它也是首款获得FDA突破性疗法认定治疗庞贝病的疗法。
庞贝病是一种由酸性α-葡萄糖苷酶(GAA)缺乏所引起的遗传性溶酶体贮积症。GAA水平的降低或缺失导致糖原在肌肉及其他组织的溶酶体中堆积,继而引发了庞贝病相关的病症(如肌无力和呼吸功能不全),甚至造成患者死亡。Amicus公司的创始人John Crowley先生的儿女均是庞贝病患者。当得知儿女患病后,这位原本对生物技术几乎一无所知的“门外汉”辞去了工作,创办了一家名为Novazyme的生物技术公司,努力为自己的子女开发新药。随着Novazyme被药企Genzyme收购,新药的开发工作也大大加速,2006年,一款名为Myozyme的疗法获得了美国FDA的认可,成为全球首个获批的庞贝病药物。
这段跌宕起伏的传奇旅程让Crowley先生深刻认识到为罕见病患者及时开发新药的重要性,也促使他创立了一家专注于罕见病药物开发的新公司。这家公司就是今日带来全新药物的Amicus Therapeutics。
Pombiliti(cipaglucosidase alfa)是一种独特的人源重组酸性α-葡萄糖苷酶,其化学结构经过优化后可加强细胞对药物的吸收;而miglustat则是一种口服酶稳定剂,旨在增强cipaglucosidase alfa的活性。这两种药物构成的组合疗法AT-GAA在临床前研究中与溶酶体中GAA酶的增加和自噬缺陷的缓解、肌肉中糖原水平降低以及肌肉力量的改善相关。
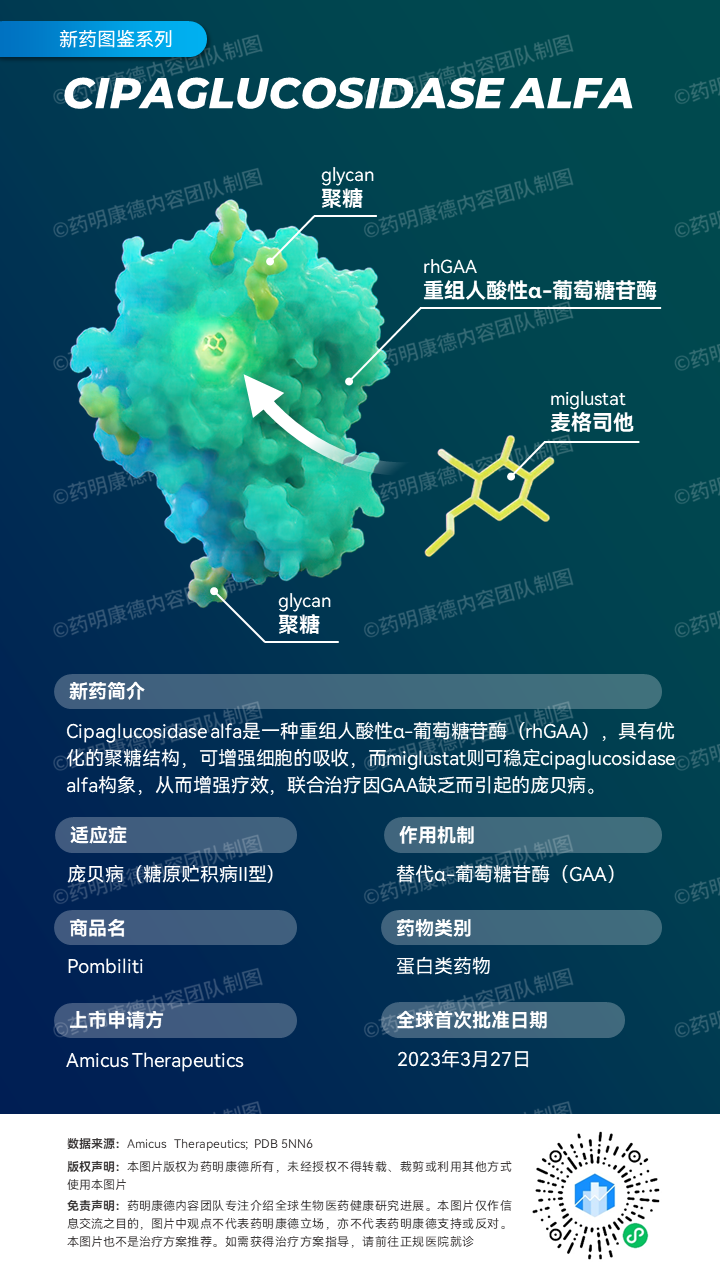
药明康德内容团队制图
AT-GAA的治疗效果和安全性也得到了临床研究的支持。此前,根据1/2期临床研究的疗效结果,FDA授予了AT-GAA治疗晚发型庞贝病的突破性疗法认定。欧盟的批准是基于关键性3期临床试验PROPEL的临床数据,3期临床试验结果显示,AT-GAA相比标准治疗方式alglucosidase alfa,在治疗晚发型庞贝病患者(包括已经过ERT治疗但治疗需求尚未得到满足的患者)方面获得了具有临床意义的改善效果。
“晚发型庞贝病是一种罕见的神经肌肉疾病,会对患者及其家人产生毁灭性的后果。欧盟委员会批准Pombiliti是为晚发型庞贝病患者带来这种急需的创新治疗方法迈出的又一重大一步。”Amicus Therapeutics 执行董事长John Crowley先生说。
参考资料:
[1] Amicus Therapeutics Announces European Commission Approval for Pombiliti™ in Patients with Late-Onset Pompe Disease. Retrieved March 27, 2023, from https://ir.amicusrx.com/news-releases/news-release-details/amicus-therapeutics-announces-european-commission-approval-1
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..