今日,SpringWorks Therapeutics公司宣布,FDA接受其口服特异性γ-分泌酶小分子抑制剂nirogacestat的新药申请(NDA),用以治疗硬纤维瘤(desmoid tumors)成人患者。同时,FDA授予此申请优先审评资格,并预计于2023年8月27日前完成审查。FDA目前并不打算针对此申请召开咨询委员会讨论。
硬纤维瘤是一种失能性并可导致毁容的罕见软组织肿瘤。它可能快速侵袭周围的健康组织,造成严重疼痛,内出血,动作范围受限,甚至死亡。历史上,硬纤维瘤的治疗方法为手术切除,然而在手术切除后肿瘤复发率非常高,导致疗效不佳。目前没有获批疗法治疗硬纤维瘤。
Nirogacestat是一款口服特异性γ-分泌酶小分子抑制剂。γ-分泌酶能够切割多种跨膜蛋白复合体,其中包括Notch蛋白。而Notch蛋白被认为能够激活导致硬纤维瘤生长的信号通路。Nirogacestat曾获得FDA授予快速通道资格、突破性疗法认定用以治疗患有进行性、不可切除、复发/难治性硬纤维瘤或深层纤维瘤病患者。除了治疗硬纤维瘤,SpringWorks还与多家公司达成研发协议,在多发性骨髓瘤患者中检验它与B细胞成熟抗原(BCMA)靶向疗法联用的效果。
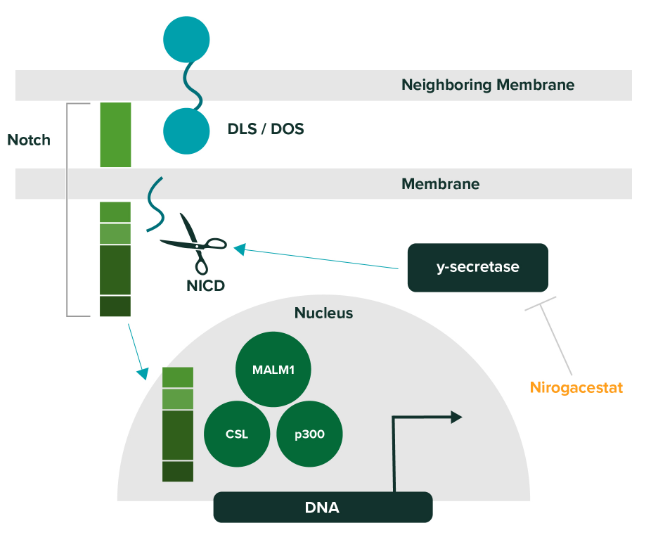
▲Nirogacestat的作用机制(图片来源:SpringWorks公司官网)
这次NDA的申请主要基于DeFi试验的结果。这一随机双盲、安慰剂对照的3期临床试验中,142名患者随机接受一天两次150 mg nirogacestat或安慰剂的治疗。试验结果显示,nirogacestat达到临床试验的主要终点,显著改善患者的无进展生存期,将患者疾病进展风险降低71%(HR=0.29,95% CI:0.15-0.55,p<0.001)。而且,临床试验达到所有关键次要终点,包括显著改善客观缓解率(ORR)和患者报告结果。安全性方面,nirogacestat耐受性良好,安全性可控。
“硬纤维瘤是一种侵袭性的软组织肿瘤,会给患者带来严重的负面结果,包括持久的疼痛、毁容和截肢。在极少数情况下,当重要器官受到影响时,硬纤维瘤也可能危及生命,”SpringWorks的首席执行官Saqib Islam博士说道,“今天的报告代表了我们目标的一个重要里程碑,即将潜在首个获批疗法带到硬纤维瘤患者群体中。我们期待与FDA分享DeFi试验数据,并在今年晚些时候的医学会议上展示详细的试验结果。”
参考资料:
[1] SpringWorks Therapeutics Announces FDA Acceptance and Priority Review of New Drug Application for Nirogacestat for the Treatment of Adults with Desmoid Tumors. Retrieved February 27, 2023 from https://ir.springworkstx.com/news-releases/news-release-details/springworks-therapeutics-announces-fda-acceptance-and-priority
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..