新年伊始,美国FDA药物评价和研究中心(CDER)发布了2022年度的新药获批报告。在这一年里,CDER一共批准了37款新药。过去10年里,CDER每年平均批准43款新药。

从创新性上看,今年FDA批准的新药里,共有20款为“first-in-class”疗法,占全年获批新药总数的54.1%(20/37)!从历史上看,“first-in-class”新药的占比与去年的54%非常接近,为近十年来的最高值。这些新药的作用机制不同于已有疗法,有潜力为大众健康带来重要的积极影响。
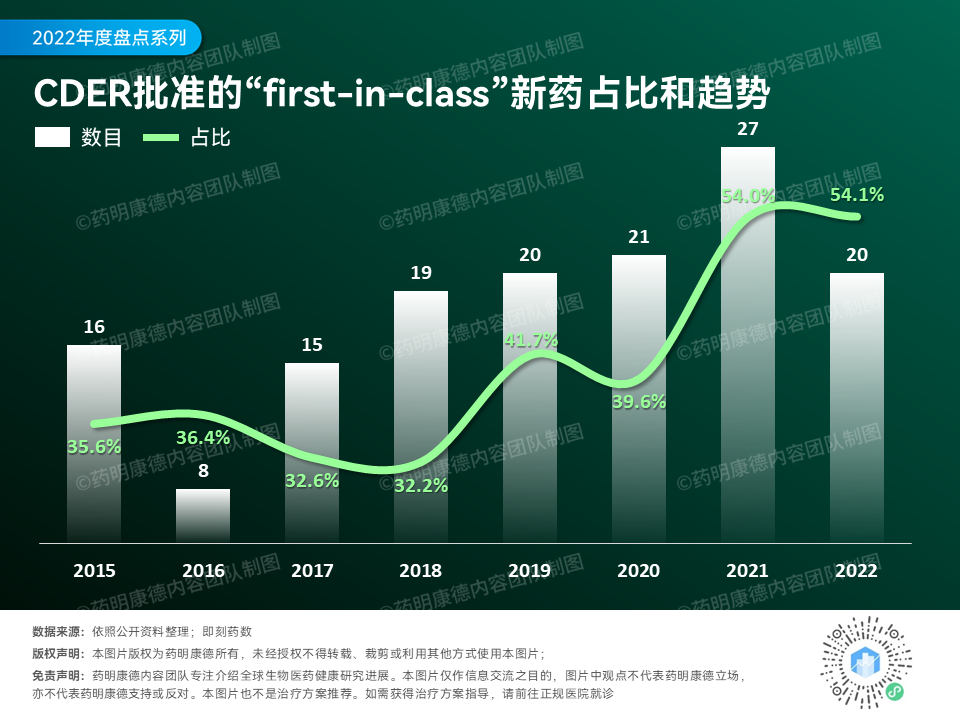
▲2015年到2022年FDA下属CDER批准的新药中,“first-in-class”(FIC)的新药数目与占比(数据来源:公开资料整理,数据来自CDER发布的年度报告)
CDER报告中着重介绍的“first-in-class”新药包括:
Camzyos(mavacamten)是一款心肌肌球蛋白别构抑制剂,用于改善特定梗阻性肥厚型心肌病(oHCM)成人患者。这是FDA批准的首款心肌肌球蛋白别构可逆性抑制剂。
Mounjaro(tirzepatide) 同时激活两种激素受体,可提供更好的血糖控制。它在去年5月获得FDA批准,用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。
Pluvicto(lutetium 177 Lu vipivotide tetraxetan)是首款用于治疗前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者的靶向放射配体疗法,它将同位素疗法与靶向化合物结合在一起。
Sunlenca(lenacapavir)是一款具有多阶段作用机制的“first-in-class”衣壳抑制剂。它在去年12月获批用于联合其他抗逆转录病毒药物治疗多重耐药人类免疫缺陷病毒(HIV)感染的成人患者。Sunlenca是首个基于衣壳抑制剂的HIV治疗选项,此“first-in-class”药物向HIV患者提供了一种新的、一年两次的治疗选择。
Tzield(teplizumab)是首款能延缓1型糖尿病发作的药物。它是一种抗CD3的单克隆抗体,它有望通过结合特定的免疫细胞,使其不再攻击生产胰岛素的细胞。
Voquezna Triple Pak(伏诺拉生,阿莫西林,克拉霉素三重组合)和Voquezna Dual Pak(伏诺拉生,阿莫西林双重组合)在去年5月获批上市,用于治疗成人幽门螺杆菌(Helicobacter pylori)感染。这两种组合均包含伏诺拉生,这是一款“first-in-class”钾离子竞争性酸阻滞剂,是美国30多年来批准的首款源于新药物类型的创新抑酸疗法。
FDA用多种方式促进和加快新药审评
在2022年获批的37款新药中,12款获得快速通道资格,13款获得突破性疗法认定,21款获得优先审评资格(不包括使用优先审评券递交监管申请的药物),6款药物获得加速批准。总计24款药物使用了一种或多种加快审评过程的资格认定。
突破性疗法的数量同样是衡量创新性的一个标准。与已有疗法相比,这些疗法在治疗特定的严重疾病时,可能表现出更好的临床效益。
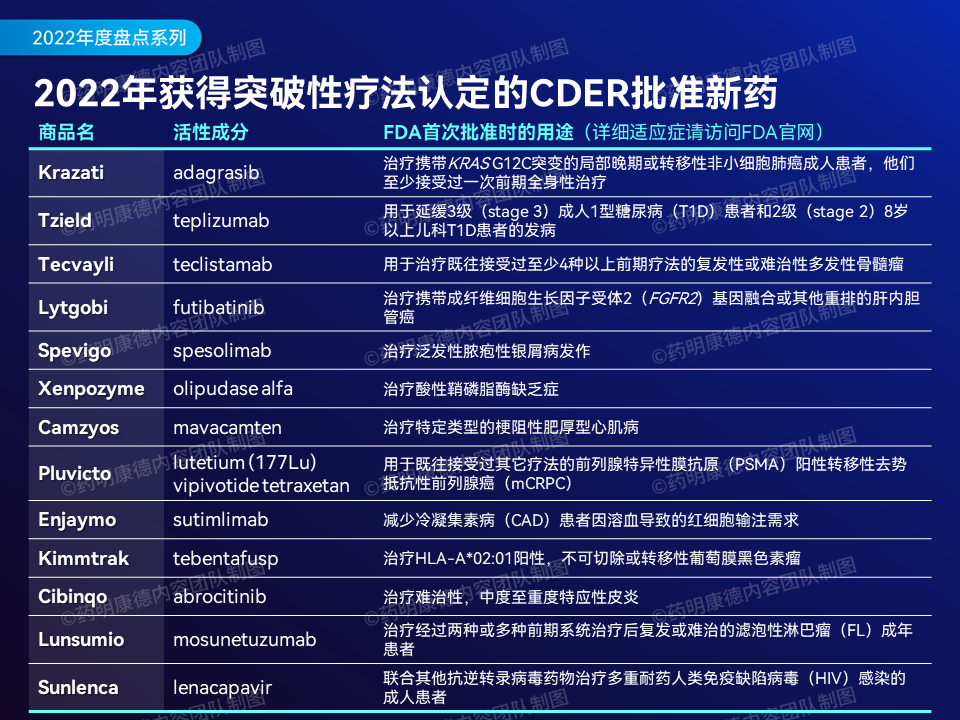
▲2022年CDER批准的获得突破性疗法认定的新药,点击图片可观看大图(数据来源:公开资料,药明康德内容团队制图)
多项批准为特定患者群体带来首款获批疗法
在报告中,CDER还着重介绍了多款值得关注的扩展适应症批准。其中多项批准为特定患者群体带来首款FDA获批疗法。它们包括:
Dupixent(dupilumab)在2022年成为首款获得FDA批准,治疗嗜酸性食管炎的疗法,同年也成为首款FDA批准的治疗结节性痒疹的药物。
Enhertu(trastuzumab deruxtecan)在2022年获得加速批准,成为首款治疗HER2低表达乳腺癌亚型患者的疗法。这是一个新的HER2阴性乳腺癌患者亚群,患者虽然在癌细胞表面表达HER2蛋白,但不足以被归类为HER2阳性。
Imcivree(setmelanotide)在2022年成为首个帮助Bardet-Biedl综合征患者控制体重的FDA获批疗法。
Olumiant(baricitinib)在2022年成为首款获批治疗COVID-19的免疫抑制剂,同时也是首款FDA批准治疗斑秃的系统性疗法。
Opdivo(nivolumab)在2022年成为首款CDER批准的肺癌新辅助疗法。
外用JAK抑制剂Opzelura(ruxolitinib)是首款获得CDER批准帮助非节段性白癜风患者恢复皮肤色素的疗法。
Pedmark(sodium thiosulfate)是首款获批用于在接受顺铂化疗的儿科患者中降低听力丧失风险的疗法。
Vidaza(azacitidine)在2022年获得CDER批准治疗年龄一个月以上的新确诊幼年粒单核细胞白血病患者。这是针对这种白血病类型的首个获批疗法。
Vijoice(alpelisib)在2022年获批治疗PIK3CA相关过度生长疾病谱系(PROS)(PROS),这是一种主要影响儿童的罕见过度生长综合征。这是针对这一适应症的首款获批疗法。
Xalkori(crizotinib)获批治疗无法切除、复发或难治性炎性ALK阳性肌纤维母细胞瘤(IMT)患者。这是用于治疗IMT的首款获批药物。
CDER报告还汇报了扩展药物使用群体的批准,以及对生物类似药的批准,可谓“干货满满”。点击文末“阅读全文/Read more“,即可下载报告全文。
在2023年,我们期望见证更多创新疗法获批,为全球病患带来新的治疗方案。药明康德内容团队也将持续报道全球新药最新进展,敬请关注!
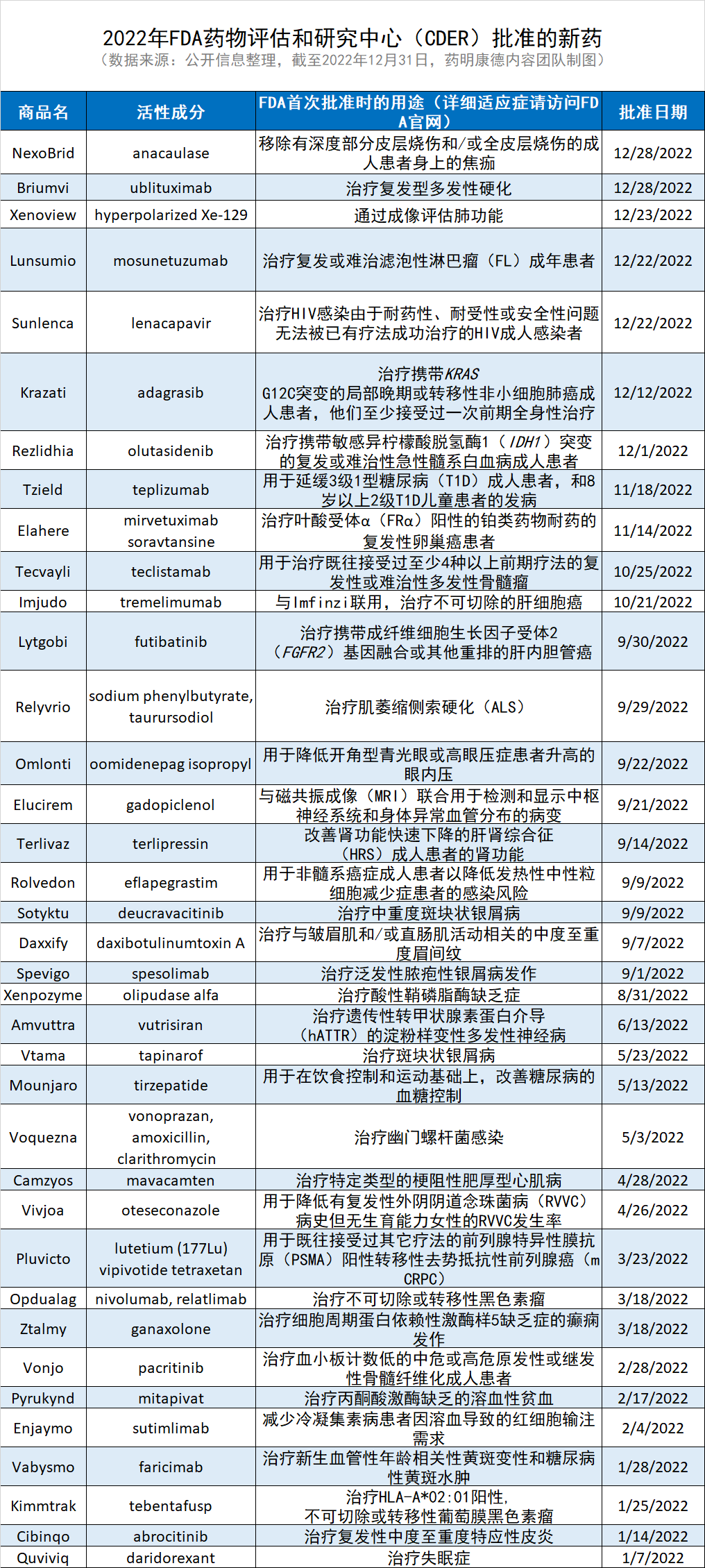
附:2021年FDA批准的新药列表,点击图片可观看大图
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..