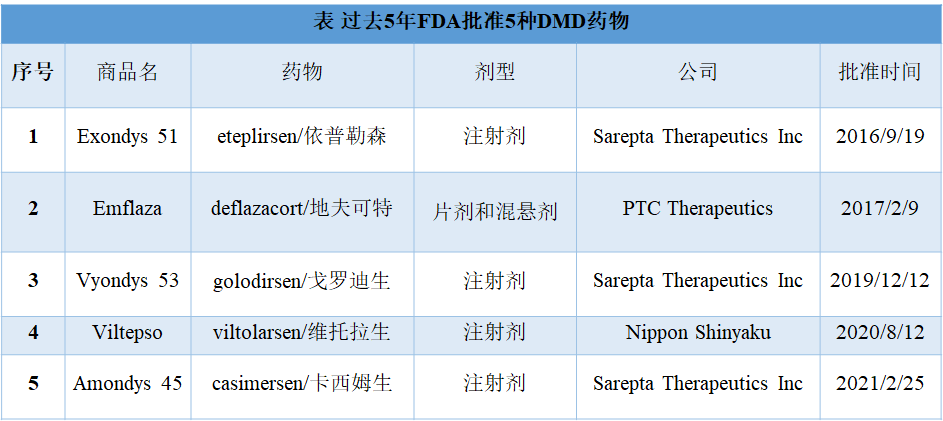
在过去5年里,FDA共批准5种DMD药物,且都将通过不同途径进入中国:
Amondys 45/Exondys 53/Vyondys 51
2016年9月,FDA批准了首款杜氏肌营养不良症(DMD)药物Sarepta Therapeutics公司的Exondys 51(Eteplirsen),用于治疗大约13%已明确51号外显子突变的DMD患者。
Sarepta Therapeutics公司的Vyondys 53(golodirsen)和Amondys 45(casimersen)分别于2019年12月和2021年2月获得FDA批准,分别用于治疗外显子45跳跃(约8%)和外显子53跳跃(约8%)DMD患者。
Amondys 45/Exondys 53/Vyondys 51均为反义寡核苷酸药物,利用Sarepta专有的磷酸二酰胺吗啉代寡聚体(PMO)化学和外显子跳过(exon-skipping)技术,分别跳过DMD基因的第45号/53号/51号外显子。3款药物被设计用于结合肌营养不良蛋白pre mRNA的第45号/53号/51号外显子,从而在携带基因突变适合跳过第45号/53号/51号外显子的DMD患者的mRNA处理过程中排除或“跳过”该外显子。外显子跳过是为了允许产生一个内部截短的肌营养不良蛋白。
日前,在博鳌乐城国际医疗旅游先行区特许医疗政策的支持下,博鳌乐城维健罕见病临床医学中心成功引入了EXONDYS 51、VYONDYS 53、AMONDYS 45。对于符合要求的DMD患者,这3种药物在乐城实现患者可及,为患者和家庭提供了多一个选择,也为患者获得良好的治疗提供了正规的路径。
延伸阅读:乐城部分罕见病药品清单来了!特许医疗援助计划助力患者医药可及
Viltepso(viltolarsen)
2020年8月,FDA批准第二种针对外显子53跳跃DMD基因突变药物上市——日本新药株式会社(Nippon Shinyaku)子公司NS Pharma开发的Viltepso(viltolarsen)。
今年1月20日,湖南省儿童医院首个国际多中心53跳跃药Viltolarsen的Ⅱ期临床试验启动。Viltolarsen未来有望通过国家药监局途径申报上市。
延伸阅读:4款反义寡核苷酸类药物强攻DMD,后续新药需补强
Emflaza(deflazacort)
2017年2月,FDA批准PTC Therapeutics公司药物Emflaza(deflazacort),用于5岁及以上DMD患者的治疗。Emflaza是全球获批治疗DMD的首个皮质类固醇药物。与其他4种反义寡核苷酸药物相比,Emflaza的适用人群更为广泛,适用于所有类型基因突变的DMD患者。
据悉,Emflaza是由西班牙Faes.Farma研发,于2003年被马拉松公司买入美国,随后又出售给PTC公司。而后在2017年,PTC公司使用了Faes.Farma的药学资料获得了美国FDA批准上市。
2018年,澳门五洲药物与西班牙Faes.Farma签收许可协议,将与Emflaza同药不同名的Defal引入中国,并在2019年获得澳门批准上市,随后借助《粤港澳大湾区药品医疗器械监管创新发展工作方案》的政策开始以低价向内地进行销售。据了解,除获得中国药监局上市许可以外,粤港澳大湾区的引进政策是目前可获得境外正规处方药品的唯一的途径。通过大湾区引进的药品,需先向港澳药监局提交注册申请所需的文件,包括生产配方,产品规格,化验报告及制造商牌照等,以供药监局审批确保出售的药物是安全、有成效和具品质。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..