肺癌是世界中死亡人数第 1多的恶性肿瘤,发表在“神刊” CA:A Cancer Journal for Clinicians 上研究指出,2022年美国有超过23.7万人新确诊肺癌,肺癌幸存者共65.5万名,近一半(45%)的幸存者至今距离诊断超过5年,即5年生存率约为45%。如今,肺癌已经成为美国死亡率下降最为显著的癌种。肺癌总死亡率年度下降速度,从1991-2013年间的2.4%,到2009-2013年间的5.0%,下降速度翻了一倍。
报告指出,肺癌死亡率的下降主要受三方面因素影响:吸烟率的显著下降、早期肺癌检测技术的进步、以及肺癌创新疗法的快速发展。
今天,DeepMed数据库为您盘点近5年来被引次数最高的15项肺癌领域临床试验文献,带大家从这些最受关注的临床研究之中窥见这5年来肺癌领域创新药物取得的突破性进展。
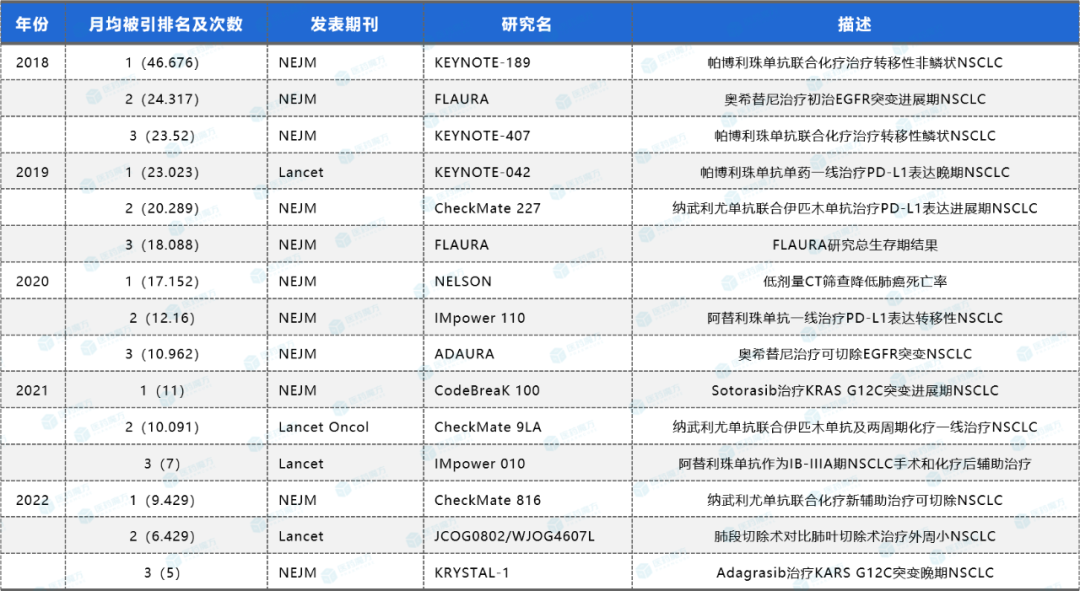
备注:本文数据引用自DeepMed数据库后台AI数据工坊cScout的统计结果,汇总2018年至今肺癌领域临床试验相关文献,纳入在Pubmed数据库内月均被引次数最高的文献共15篇(每年3篇),按次数降序排列。如有问题,欢迎留言补充。关于DeepMed数据库的介绍及试用渠道,请查看文末。
表1:近5年15篇月均被引次数最高肺癌临床研究列表(来源:医药魔方DeepMed数据库)
2018年
2018年NO1:KEYNOTE-189研究-帕博利珠单抗联合化疗治疗转移性非鳞状非小细胞肺癌
标题:Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer.【1】
作者:Leena Gandhi等
期刊&时间:N Engl J Med. 2018 May 31;378(22):1533-4406.
PMID: 29658856 DOI: 10.1056/NEJMoa1801005
NCT IDs: NCT02578680
Pubmed总引用数:1587;月均被引数:46.676
KEYNOTE-189研究是一项双盲、随机、平行对照III期临床试验,旨在针对晚期非鳞状非小细胞肺癌患者,应用帕博利珠单抗+培美曲塞+铂类,对比培美曲塞+铂类,主要终点为OS和PFS。
2018年发表于NEJM的结果显示:帕博利珠单抗联合化疗能显著延长OS(中位NR vs 11.3个月,HR 0.49,P<0.001),显著延长PFS(中位8.8 vs 4.9个月,HR 0.52,P<0.001),PD-L1 TPS<1%、1-49%、≥50%的两组OS获益均存在统计学差异。
研究结论:在既往未治疗且无EGFR或ALK突变的转移性非鳞状NSCLC患者,相比培美曲塞/铂类,帕博利珠单抗+培美曲塞+铂类明显延长了总生存期(OS)和无进展生存期(PFS)。
基于此研究,2017年5月FDA批准了帕博利珠单抗联合培美曲塞加卡铂作为转移性非鳞状NSCLC的一线治疗。
2018年NO2:FLAURA研究-奥希替尼治疗初治EGFR突变进展期非小细胞肺癌
标题:Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer.【2】
作者:Jean-Charles Soria等
期刊&时间:N Engl J Med. 2018 01 11;378(2):1533-4406.
PMID: 29151359 DOI: 10.1056/NEJMoa1713137
NCT IDs: NCT02296125, NCT02296125
Pubmed总引用数:1459;月均被引次数:24.317
FLAURA研究是一项双盲随机、平行对照、多中心III期试验,选取未经治疗的局部进展(无法手术或放疗)和晚期EGFR突变(外显子19缺失或21L858R突变)NSCLC患者,1:1随机分为奥希替尼和标准EGFR-TKI(吉非替尼或厄洛替尼),主要终点为PFS。
2018年首次发布于NEJM的研究结果显示:奥希替尼组PFS显著延长(中位18.9 vs 10.2个月,HR 0.46,P<0.001),无论是否发生脑转移均有获益。奥希替尼组18个月的OS率也显著更高(83% vs 71%,HR 0.63,P=0.007),中位DoR更长,ORR更高,并且3-5级不良反应率更低。
研究结论:在未经治疗的EGFR突变阳性(外显子19缺失和L858R突变)局部晚期或转移性NSCLC患者的一线治疗中,奥希替尼的疗效优于标准EGFR-TKI,且严重不良事件发生率低于后者;在安全性方面,两者相似。
基于该研究,2018年4月FDA批准了奥希替尼一线治疗EGFR突变转移性NSCLC患者,第2年该药也获得了我国NMPA批准。
2018年NO3:KEYNOTE-407研究-帕博利珠单抗联合化疗治疗转移性鳞状非小细胞肺癌
标题:Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer.【3】
作者:Luis Paz-Ares等
期刊&时间:N Engl J Med. 2018 11 22;379(21):1533-4406.
PMID: 30280635 DOI: 10.1056/NEJMoa1810865
NCT IDs: NCT02775435
Pubmed总引用数:1176;月均被引次数:23.52
KEYNOTE-407研究与KEYNOTE-189研究的研究设计非常类似,都是帕博利珠单抗联合化疗对比单纯化疗治疗晚期NSCLC的III期临床试验,但是前者针对鳞癌,后者针对非鳞癌。
2018年发表于NEJM的KEYNOTE-407研究结果显示,帕博利珠单抗+紫杉醇/白蛋白紫杉醇+卡铂对比单纯化疗,能够显著延长OS(中位15.9 vs 11.3个月,HR 0.64,P<0.001),显著延长PFS(中位6.4 vs 4.8个月,HR 0.56,P<0.001),PD-L1表达的亚组各都能见到显著差异。
图片图:KEYNOTE-407研究主要结果(来源:医药魔方DeepMed数据库)
研究结论:对于既往未经治疗的转移性鳞状NSCLC患者,帕博利珠单抗+卡铂+紫杉醇或白蛋白紫杉醇显著延长了患者的总生存期(OS)和无进展生存期(PFS)。
基于该研究结果,2018年,FDA批准了该方案一线治疗晚期鳞状非小细胞肺癌。
2019年
2019年NO1:KEYNOTE-042研究-帕博利珠单抗单药一线治疗PD-L1表达的晚期非小细胞肺癌
标题:Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial.【4】
作者:Tony S K Mok等
期刊&时间:Lancet. 2019 05 04;393(10183):1474-547X.
PMID: 30955977 DOI: 10.1016/S0140-6736(18)32409-7
NCT IDs: NCT02220894
Pubmed总引用数:990;月均被引次数:23.023
2018年的两项K药重磅研究(KEYNOTE-189和407)都是针对所有晚期肺癌患者确证帕博利珠单抗联合化疗一线治疗的疗效,而2019年出炉的KEYNOTE-042研究则直接将视角转向了晚期肺癌“去化疗”方案。
KEYNOTE-042研究是一项非盲开放、随机、平行对照III期临床试验,主要选取PD-L1 TPS评分1%或更高,EGFR和ALK突变阴性的局部进展或晚期NSCLC患者,1:1随机入组给予帕博利珠单抗或化疗治疗。
2019发布于Lancet的研究结果显示:对于PD-L1 TPD≥1%的总人群,帕博利珠单抗单药能显著延长OS(中位16.7 vs 12.1个月,HR 0.81,P=0.0018),其中PD-L1≥50%亚组差异最明显(中位20.0 vs 12.2个月)。帕博利珠单抗组的3级或以上不良反应发生率明显降低(18% vs 41%)。
研究结论:对于PD-L1 TPS≥1%且EGFR/ALK突变阴性的局部晚期或转移性NSCLC患者,风险疗效分析提示帕博利珠单抗单药可以作为一线治疗方案。
基于该研究结果,2019年4月FDA批准帕博利珠单抗单药用于治疗PD-L1≥1%且无驱动基因突变的局部进展或晚期NSCLC患者的一线治疗。
2019年NO2:CheckMate 227研究-纳武利尤单抗加伊匹木单抗治疗进展期PD-L1表达非小细胞肺癌
标题:Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer.【5】
作者:Matthew D Hellmann等
期刊&时间:N Engl J Med. 2019 11 21;381(21):1533-4406.
PMID: 31562796 DOI: 10.1056/NEJMoa1910231
NCT IDs: NCT02477826
Pubmed总引用数:771;月均被引次数:20.289
在KEYNOTE-042研究发表半年之后,CheckMate 227研究同样将目光聚焦在了PD-L1≥1%的晚期NSCLC人群的“去化疗”一线治疗上,将人群1:1:1随机分为3组:纳武利尤单抗+伊匹木单抗、纳武利尤单抗单药、化疗组。
2019年11月发表于NEJM的结果显示:与化疗相比,纳武利尤单抗联合伊匹木单抗能显著延长OS(中位17.1 vs 14.9个月,HR 0.79,P=0.007),2年OS率显著提升(40% vs 32.8%),ORR和中位DoR也有提升,3-5级不良反应率相对更低。
研究结论:在NSCLC患者中,纳武利尤单抗+伊匹木单抗一线治疗组的总生存期超过化疗组,且与PD-L1表达水平无关。长期随访中未发现新的安全性问题。
基于该研究结果,2020年5月FDA批准了该方案治疗既往未经治疗的PD-L1≥1%、无EGFR/ALK突变的转移性NSCLC患者。
2019年NO3:FLAURA研究总生存期结果
标题:Overall Survival with Osimertinib in Untreated, EGFR -Mutated Advanced NSCLC.【6】
作者:Suresh S Ramalingam等
期刊&时间:N Engl J Med. 2020 01 02;382(1):1533-4406.
PMID: 31751012 DOI: 10.1056/NEJMoa1913662
NCT IDs: NCT02296125
Pubmed总引用数:615;月均被引次数:18.088
2018年发表于NEJM的FLAURA研究首次结果主要展示了PFS的相关数据,随后2019年,NEJM发表了该研究的OS结果:与吉非替尼或厄洛替尼相比,应用奥希替尼能显著延长EGFR突变进展期NSCLC的OS(中位:38.6 vs 31.8个月,HR 0.8,P=0.046),3年OS率显著提升(28% vs 9%),3-5级不良反应发生率略降低(42% vs 47%)。
研究结论:在既往未经治疗的 EGFR 突变的晚期 NSCLC 患者中,接受奥希替尼治疗的患者的总生存期比接受吉非替尼或厄洛替尼治疗的患者显著延长。尽管奥希替尼组的暴露持续时间更长,但奥希替尼的安全性与对照 EGFR-TKI 相似。
2020年
2020年NO1:NELSON研究-低剂量CT筛查降低肺癌死亡率
标题:Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial.【7】
作者:Harry J de Koning等
期刊&时间:N Engl J Med. 2020 02 06;382(6):1533-4406.
PMID: 31995683 DOI: 10.1056/NEJMoa1911793
Pubmed总引用数:566;月均被引次数:17.152
在男性和吸烟人群中是否该进行低剂量CT检查筛查肺癌,长期以来备受争议。2020年,NEJM的这项NELSON研究为支持CT筛查添加了强大的循证证据。
这项荷兰的研究纳入了50-74岁、有长期吸烟史的13195名男性和2594名女性,并随机分为CT筛查组(加入研究时、第1年、第3年、第5.5年进行四轮筛查)和观察组,进行至少10年的随访。
研究结果发现,CT筛查的依从性为90%,总体可疑结节发生率为2.1%。到10年随访期截止,筛查组与观察组的肺癌发生率分别为5.58和4.91每1000人,其中筛查组中所有肺癌病例有59%源于筛查发现,且筛查发现的患者更多在癌症早期。两组肺癌死亡率分别为2.50和3.30每1000人。筛查组的10年累积肺癌死亡风险下降了24%(HR 0.76,95% CI 0.61-0.94,P=0.01)。并且女性获益更明显,筛查组的死亡风险下降了32%。
研究结论:通过对高危人群的低剂量CT筛查,肺癌死亡率明显降低。
2020年NO2:IMpower110研究-阿替利珠单抗一线治疗PD-L1表达转移性非小细胞肺癌
标题:Atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC.【8】
作者:Roy S Herbst等
期刊&时间:N Engl J Med. 2020 10 01;383(14):1533-4406.
PMID: 32997907 DOI: 10.1056/NEJMoa1917346
NCT IDs: NCT02409342
Pubmed总引用数:304;月均被引次数:12.16
继K药和O药等免疫抑制剂相继获批一线晚期非小细胞肺癌适应症之后,T药也加入了晚期“无化疗”方案的研究大军。IMpower110研究是一项随机开放、平行对照III期临床试验,针对未经治疗、PD-L1表达的转移性NSCLC,1:1随机分配至阿替利珠单抗或化疗组。
2020年发表于NEJM的研究结果显示,在PD-L1≥50% (TC) 或≥10% (IC)的人群中,阿替利珠单抗组显著延长OS(中位:20.2 vs 13.1个月,HR 0.59,P=0.01),显著延长PFS(中位:8.1 vs 5.0个月),且显著提升ORR和DoR,降低3或4级不良反应发生率(30.1% vs 52.5%)。在高TMB人群中也可见阿替利珠单抗组在OS和PFS的获益。
研究结论:对于PD-L1高表达的NSCLC患者(无论组织类型如何),阿替利珠单抗都可以显著延长总生存期。
基于该研究,2020年5月,FDA批准了阿替利珠单抗一线单药治疗EGFR/ALK阴性,PD-L1高表达(TC≥50%或IC≥10%)转移性非小细胞肺癌患者。
2020年NO3:ADAURA研究-奥希替尼治疗可切除EGFR突变非小细胞肺癌
标题:Osimertinib in Resected EGFR -Mutated Non-Small-Cell Lung Cancer.【9】
作者:Yi-Long Wu等
期刊&时间:N Engl J Med. 2020 10 29;383(18):1533-4406.
PMID: 32955177 DOI: 10.1056/NEJMoa2027071
NCT IDs: NCT02511106
Pubmed总引用数:285;月均被引次数:10.962
ADAURA研究是一项双盲随机、平行对照多中心III期临床试验,主要针对Ib-IIIA期经历完全切除手术的EGFR突变阳性NSCLC患者,1:1随机分配至奥希替尼辅助治疗(80mg每天,3年)或安慰剂组,评估其DFS(无病生存期)、OS和安全性情况。
2020年发表于NEJM的结果显示:在II-IIIA期患者中,奥希替尼组DFS显著延长(中位:NR vs 19.6个月,HR 0.17,P<0.001),2年DFS率显著提升(90% vs 44%)。IB-IIIA期患者也同样看到奥希替尼组DFS延长。奥希替尼组的远处复发率和脑转移率也显著降低。数据截止前,奥希替尼组9人死亡,安慰剂组20人死亡。
研究结论:在ⅠB-ⅢA期EGFR突变阳性的非小细胞肺癌患者中,接受奥希替尼辅助治疗患者的无病生存期显著长于接受安慰剂的患者。
基于该研究结果,2020年12月,FDA批准奥希替尼治疗EGFR敏感突变的手术后患者。2021年4月,我国NMPA也批准了奥希替尼该适应症。
2021年
2021年NO1:CodeBreaK 100研究-Sotorasib治疗KRAS p.G12C突变进展期非小细胞肺癌
标题:Sotorasib for Lung Cancers with KRAS p.G12C Mutation.【10】
作者:Ferdinandos Skoulidis等
期刊&时间:N Engl J Med. 2021 06 24;384(25):1533-4406.
PMID: 34096690 DOI: 10.1056/NEJMoa2103695 PMC: PMC9116274
NCT IDs: NCT03600883
Pubmed总引用数:187;月均被引次数:11
CodeBreaK 100研究是一项非盲开放、随机单臂II期临床试验,主要针对既往经过标准治疗,存在KRAS p.G12C突变的进展期非小细胞肺癌患者,给予Sotorasib口服治疗,主要终点为ORR。
2021年发表于NEJM的研究结果显示:124名患者中,ORR达到37.1%,其中3.2%达到CR,33.9%达到PR,中位DoR为11.1个月,疾病控制率DCR为80.6%,中位PFS为6.8个月,中位OS为12.5个月。3级不良反应发生率为19.8%,4级为0.8%。
研究结论:在这项2期试验中,既往经过治疗的KRAS G12C突变NSCLC患者在接受Sotorasib 治疗后产生了持久的临床益处,且没有新的安全风险。
基于这项研究的主要结果,2021年5月FDA批准Sotorasib用于治疗至少接受过1种系统治疗的KRAS G12C突变的局部进展期或转移性NSCLC患者。
2021年NO2:CheckMate 9LA-纳武利尤单抗联合伊匹木单抗及两周期化疗一线治疗非小细胞肺癌
标题:First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial.【11】
作者:Luis Paz-Ares等
期刊&时间:Lancet Oncol. 2021 02;22(2):1474-5488.
PMID: 33476593 - PII: S1470-2045(20)30641-0 - DOI: 10.1016/S1470-2045(20)30641-0
NCT IDs: NCT03215706
Pubmed总引用数:222;月均被引次数:10.091
2019年发表的CheckMate 227研究支持O+Y方案在PD-L1≥1%晚期非小细胞肺癌的一线治疗证据,而2021年发表于Lancet Oncol的CheckMate 9LA研究是一项非盲开放、随机对照III期临床试验,将受试人群进一步扩大到全部驱动基因阴性晚期非小细胞肺癌患者,应用纳武利尤单抗+伊匹木单抗+含铂双药化疗,对比含铂双药化疗的疗效和安全性。
研究结果显示:O+Y+化疗方案较单纯化疗相比,能显著延长患者的OS(中位随访9.7个月,14.1 vs 10.7个月,HR 0.69,P=0.00065),提升ORR(38.2% vs 24.9%),显著延长DoR(中位:11.3 vs 5.6个月)。两组的3-4级不良反应发生率分别为47%和38%,与3-4级治疗相关的最常见的不良事件是中性粒细胞减少、贫血、腹泻、脂肪酶升高、乏力。
研究结论:相比单独化疗,纳武利尤单抗联合伊匹木单抗伴两周期化疗一线治疗显著改善了患者的总体生存率,且风险-获益良好。该研究结果支持双免疫治疗方案作为晚期非小细胞肺癌患者新的一线治疗选择。
基于这项研究前期初步结果,2020年5月FDA批准该方案用于治疗EGFR/ALK阴性转移性非小细胞肺癌一线治疗。
2021年NO3:IMpower010研究-阿替利珠单抗作为IB-IIIA期非小细胞肺癌手术和化疗后辅助治疗
标题:Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial.【12】
作者:Enriqueta Felip等
Lancet. 2021 10 09;398(10308):1474-547X.
PMID:34555333 PII:S0140-6736(21)02098-5 DOI: 10.1016/S0140-6736(21)02098-5
NCT IDs: NCT02486718
Pubmed总引用数:98;月均被引次数:7
IMpower010研究是一项非盲开放、随机对照III期临床试验,主要纳入IB-IIIA期经过完全切除术和辅助铂类化疗的非小细胞肺癌患者,1:1随机分配至阿替利珠单抗或最佳支持治疗,评估两种疗法的有效性和安全性差异。
2021年发表于Lancet的研究结果显示:在II-IIIA期且PD-L1 TC≥1%的患者中,阿替利珠单抗组较支持治疗组的DFS(无病生存期)显著延长(中位:NR vs 35.3个月,HR 0.66,P=0.0039),对于所有II-IIIA期患者和所有ITT(意向治疗)人群,阿替利珠单抗组的DFS都有显著延长(中位:42.3 vs 35.3个月,HR 0.79,P=0.020;中位:NR vs 37.2个月,HR 0.81,P=0.040)。
研究结论:在II-IIIA期NSCLC患者中,阿替利珠单抗作为手术和化疗后的辅助治疗,相比最佳支持治疗能显著延长DFS,具有统计学差异,其中阿替利珠单抗在PD-L1 TC≥1%亚组中获益最明显。阿替利珠单抗的安全性与既往研究一致。
基于研究结果,2021年10月FDA批准了阿替利珠单抗用于PD-L1 TC≥1%,II-IIIA期非小细胞肺癌患者在术后和化疗后的辅助治疗。
2022年
2022年NO1:CheckMate816研究-纳武利尤单抗联合化疗新辅助治疗可切除非小细胞肺癌
标题:Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer.【13】
作者:Patrick M Forde等
期刊&时间:N Engl J Med. 2022 05 26;386(21):1533-4406.
PMID: 35403841 - DOI: 10.1056/NEJMoa2202170
NCT IDs: NCT02998528
Pubmed总引用数:66;月均被引次数:9.429
CheckMate816研究是一项非盲开放、随机对照III期临床试验,主要纳入IB-IIIA可切除非小细胞肺癌患者,随机分为纳武利尤单抗联合铂类化疗,或单纯铂类化疗治疗,随后再进行手术。主要终点为EFS(无事件生存)和PCR(病理完全缓解)。
2022年发表于NEJM的研究结果显示:纳武利尤单抗联合化疗能显著延长EFS(中位:31.6 vs 20.8个月,HR 0.63,P=0.005),显著提高PCR率(24% vs 2.2%,OR 13.94,P<0.001),死亡风险比为0.57(95%CI 0.30-1.07)。手术率分别为83.2%和75.4%,3-4级不良反应发生率分别为33.5%和36.9%。
研究结论:在可切除的NSCLC患者中,新辅助的纳武利尤单抗联合化疗比单独的化疗能带来显著的无事件生存期和病理完全缓解率获益,且未增加不良事件的发生率或阻碍手术的可行性。
基于该研究结果,2022年3月,FDA批准纳武利尤单抗联合化疗用于可切除(肿瘤≥4cm或淋巴瘤阳性)非小细胞肺癌的新辅助治疗。
2022年NO2:JCOG0802/WJOG4607L研究-肺段切除术对比肺叶切除术治疗外周小直径非小细胞肺癌
标题:Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open-label, phase 3, randomised, controlled, non-inferiority trial.【14】
作者:Hisashi Saji等
期刊&时间:Lancet. 2022 04 23;399(10335):1474-547X.
PMID: 35461558 - PII: S0140-6736(21)02333-3 - DOI: 10.1016/S0140-6736(21)02333-3
Pubmed总引用数:45;月均被引次数:6.429
肺叶切除术是早期NSCLC的标准治疗手段,但对于一些外周小肺癌,是否能进行肺段切除术目前尚有争议。JCOG0802/WJOG4607L研究是一项日本的随机对照多中心研究,选择肿瘤直径≤2cm,CTR(实性成分百分比)>0.5的IA期非小细胞肺癌患者,1:1随机分配至肺段切除术和肺叶切除术。
研究结果发现:1106名患者中,中位随访了7.3年,肺段切除术组和肺叶切除术组的5年总生存率分别是94.3%和91.1%,通过分层Cox回归模型确认了总生存期的优效性和非劣效性(HR 0.663,非劣效性 p<0.001,优越性 p=0.0082)。在所有预定义亚组中均观察到了肺段切除术的总生存预后益处。
在第1年随访期间,两组的1秒用力呼气中位减少量差异显著(3.5%,p<0.0001),但未达到预定义的临床意义阈值10%。肺段切除术组和肺叶切除术组的5年无复发生存率分是88.0%和87.9%(HR 0.998, p=0.9889)。肺段切除术组和肺叶切除术组的局部复发率分别是10.5%和5.4%(p=0.0018)。两组术后2级及以上的并发症的发生率相近。
研究结论:这项研究是首个证明肺段切除术与肺叶切除术对小外周 NSCLC 患者总生存期益处的 3 期试验。研究结果表明,肺段切除术可成为这类患者的标准手术方式。
2022年NO3:KRYSTAL-1研究-Adagrasib治疗KRAS G12C突变晚期非小细胞肺癌
标题:Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRAS [G12C] Mutation.【15】
作者:Pasi A Jänne等
期刊&日期:N Engl J Med. 2022 07 14;387(2):1533-4406.
PMID: 35658005 - DOI: 10.1056/NEJMoa2204619
NCT IDs: NCT03785249
Pubmed总引用数:25;月均被引次数:5
KRYSTAL-1研究是一项非盲开放的I/II期临床试验,主要针对既往接受过铂类化疗和PD-1/PD-L1抑制剂治疗的KRAS G12C突变非小细胞肺癌患者,给予Adagrasib治疗,评估其有效性和安全性。
2022年发表于NEJM的II期结果显示:112名患者中,平均随访12.9个月,ORR达到42.9%,中位DoR为8.5个月,中位PFS为6.5个月。截止中位随访15.6个月时,中位OS为12.6个月,脑转移患者的ORR为33.3%。治疗相关不良反应为974%,3级以上发生率为44.8%,6.9%患者停药。
图片图:KRYSTAL-1研究主要结果(来源:医药魔方DeepMed数据库)
研究结论:在既往接受过治疗的KRASG12C突变的NSCLC患者中,Adagrasib显示出临床疗效,而没有新的安全信号。
参考文献:
1.Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018 May 31;378(22):2078-2092. doi: 10.1056/NEJMoa1801005. Epub 2018 Apr 16. PMID: 29658856.
2. Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Jan 11;378(2):113-125. doi: 10.1056/NEJMoa1713137. Epub 2017 Nov 18. PMID: 29151359.
3.Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med. 2018 Nov 22;379(21):2040-2051. doi: 10.1056/NEJMoa1810865. Epub 2018 Sep 25. PMID: 30280635.
4.Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet. 2019 May 4;393(10183):1819-1830. doi: 10.1016/S0140-6736(18)32409-7. Epub 2019 Apr 4. PMID: 30955977.
5.Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2019 Nov 21;381(21):2020-2031. doi: 10.1056/NEJMoa1910231. Epub 2019 Sep 28. PMID: 31562796.
6.Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med. 2020 Jan 2;382(1):41-50. doi: 10.1056/NEJMoa1913662. Epub 2019 Nov 21. PMID: 31751012.
7.de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial. N Engl J Med. 2020 Feb 6;382(6):503-513. doi: 10.1056/NEJMoa1911793. Epub 2020 Jan 29. PMID: 31995683.
8.Herbst RS, Giaccone G, de Marinis F, et al. Atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC. N Engl J Med. 2020 Oct 1;383(14):1328-1339. doi: 10.1056/NEJMoa1917346. PMID: 32997907.
9.Wu YL, Tsuboi M, He J, et al. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Oct 29;383(18):1711-1723. doi: 10.1056/NEJMoa2027071. Epub 2020 Sep 19. PMID: 32955177.
10.Skoulidis F, Li BT, Dy GK, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med. 2021 Jun 24;384(25):2371-2381. doi: 10.1056/NEJMoa2103695. Epub 2021 Jun 4. PMID: 34096690; PMCID: PMC9116274.
11.Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial. Lancet Oncol. 2021 Feb;22(2):198-211. doi: 10.1016/S1470-2045(20)30641-0. Epub 2021 Jan 18. Erratum in: Lancet Oncol. 2021 Mar;22(3):e92. PMID: 33476593.
12.Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357. doi: 10.1016/S0140-6736(21)02098-5. Epub 2021 Sep 20. Erratum in: Lancet. 2021 Sep 23;: PMID: 34555333.
13.Forde PM, Spicer J, Lu S, Provencio M, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022 May 26;386(21):1973-1985. doi: 10.1056/NEJMoa2202170. Epub 2022 Apr 11. PMID: 35403841.
14.Saji H, Okada M, Tsuboi M, et al. Segmentectomy versus lobectomy in small-sized peripheral non-small-cell lung cancer (JCOG0802/WJOG4607L): a multicentre, open-label, phase 3, randomised, controlled, non-inferiority trial. Lancet. 2022 Apr 23;399(10335):1607-1617. doi: 10.1016/S0140-6736(21)02333-3. PMID: 35461558.
15.Jänne PA, Riely GJ, Gadgeel SM, et al. Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRASG12C Mutation. N Engl J Med. 2022 Jul 14;387(2):120-131. doi: 10.1056/NEJMoa2204619. Epub 2022 Jun 3. PMID: 35658005.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..