自从近 30 年前首次成功地将信使核糖核酸 (mRNA) 作为疫苗应用于临床前研究以来,mRNA 技术领域取得了许多进展。研究已经揭示了 mRNA 疫苗独特的有利特性,包括它们产生无毒、有效免疫反应的能力以及快速设计和放大生产的潜力,使其成为 COVID-19大流行期间的优秀候选疫苗。
实际上,获得加速监管授权的前2种针对 COVID-19 的疫苗是核苷修饰的 mRNA 疫苗,在关键的 III 期临床试验中,它们显示出对有症状的严重急性呼吸综合症冠状病毒 2 (SARS-CoV-2) 感染具有 90% 以上的保护功效,同时具有可耐受的安全性。使用 mRNA 疫苗开展全球疫苗接种运动后的真实世界证据支持了临床试验数据,并进一步表明该技术可以安全有效地用于对抗 COVID-19。这一前所未有的成功也凸显了这一新药类别的更广泛潜力,不仅适用于其它传染病,还适用于其它适应症,如肿瘤和遗传性疾病。本文将介绍4种mRNA疫苗平台的简史和发展现状,核苷修饰和未修饰的mRNA、环状RNA和自扩增RNA,并概述COVID-19 mRNA疫苗的最新进展和现状。我们还将讨论这些技术当前和预期的挑战,这可能对未来的研究工作和临床应用至关重要。[编译者注:原文发表时间为2022年5月]。
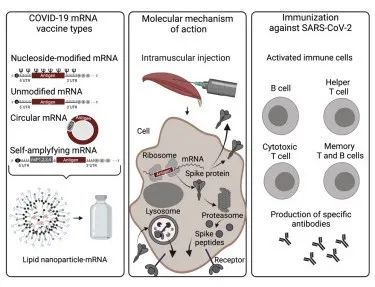
Par 1 介绍
疫苗是预防、控制和/或根除传染病的重要工具,是全球公共卫生计划的基本组成部分。有效的COVID-19 疫苗的开发和获批是大流行期间的一个重要里程碑。行业启动了大量平行的疫苗开发项目,以对抗由以前未知的病原体 - 严重急性呼吸综合症冠状病毒 2 (SARS-CoV-2) - 引起的疾病。根据世界卫生组织的疫苗追踪记录,截至2022年1月14日,共有333种候选疫苗正在开发中,其中139种至少已进入临床阶段。
快速开发和高效的免疫反应将信使核糖核酸 (mRNA) 技术带到了 COVID-19 疫苗竞赛的最前沿,主要是因为该技术仅需要测序的病毒基因组而不是活病毒,并且只需要几天时间。此外,无细胞疫苗生产的规模放大相对简单,从而为对抗大流行病的快速反应提供了尖端工具。已进入临床的 COVID-19 疫苗在撰写本文时,有 23 个(17%)的试验是基于 mRNA 的候选疫苗。此外,前2种获得欧洲药品管理局有条件上市许可(CMA)或美国食品和药物管理局紧急使用许可(EUA)的疫苗分别是来自 BioNTech/Pfizer 和 Moderna 的核苷修饰 mRNA 疫苗,其在 III 期临床试验中,显示出针对症状性 SARS-CoV-2 感染超过 90% 的保护功效,超出了之前的预期。
在本文中,我们将总结候选疫苗的临床前和临床数据,这些候选疫苗分为4种 mRNA 疫苗平台:非复制线性核苷修饰和未修饰的 mRNA、环状 RNA (circRNA) 和自扩增 RNA (saRNA)。此外,我们还将讨论可能阻碍未来疫苗开发计划的潜在挑战。
Part 2 COVID-19 mRNA 疫苗开发之路
与开发相对缓慢且费力的传统疫苗相比,基于 mRNA 的疫苗具有可以快速设计和规模放大的特点,同时仍然具有高效力和低成本。虽然mRNA 疫苗已经在在其它疾病(例如肿瘤)的临床试验中进行了研究,但直到 COVID-19 大流行,其深远的潜力才得以实现,其中 mRNA 疫苗候选者是最早进入临床试验并获得加速监管批准的一类疫苗。没有过去三十年的广泛研究和技术进步,是不可能取得这一成就的。本节将重点介绍了一些最重要的突破,这些突破最终为 COVID-19 mRNA 疫苗的开发和获批开辟了道路。
mRNA 发现之后,这一领域的研究激增,并产生了多项科学突破,最终导致了基于 RNA 的疫苗的开发。此前,对裸mRNA的较低细胞摄取阻碍了对mRNA特性的检查。然而,1978 年首次成功开发了保护性脂质制剂,该研究将兔网织红细胞 9S mRNA 引入小鼠淋巴细胞中,实现了珠蛋白合成,使得后续 mRNA 研究变得不那么复杂。同年,在使用脂质体 mRNA 转运后,人类细胞中的蛋白质表达也得到了诱导。后来,通过将合成的阳离子脂质掺入脂质体进行 mRNA 转运,进一步提高了转染效率。
脱氧核糖核酸 (DNA) 依赖性 RNA 聚合酶的鉴定是使用 DNA 模板进行体外 mRNA 转录(IVT) 的关键步骤。IVT 于 1984 年首次发表,它使基于模板以所需数量转录选定的功能性 mRNA 成为可能。直到 1993 年,mRNA 才首次被用作疫苗,以在临床前环境中,诱发针对编码的病原体抗原的特异性免疫反应,研究使用基于脂质的递送策略。之后又过了 20 年,针对传染病的 mRNA 疫苗在 I 期、概念验证、临床试验中进行了研究。鉴于脂质体在临床应用中的潜在毒性,第一个获批的小干扰 RNA 脂质纳米颗粒 (LNP) 治疗药物和 mRNA COVID-19 疫苗的成功仅源于它们使用含有可电离脂质的 LNP,已知其在静脉 (i.v.) 注射后的肝细胞中或肌内注射(i.m.)后的肌肉细胞中的递送效率显著提高。此外,最近发现 LNP 具有有效的佐剂功能,这进一步证明了它们在疫苗应用中的有益作用。
多年来,缺乏稳定性以及先天免疫激活是开发 mRNA 作为药物的重要问题。含有尿苷的 mRNA 可刺激先天免疫反应,并在用作疫苗时具有既定的佐剂功能。然而,将修饰的核苷掺入 mRNA 可显著提高 mRNA 的生物学稳定性和翻译能力,同时降低先天免疫。使用高压液相色谱 (HPLC)、快速蛋白质液相色谱 (FPLC)、oligo (dT) 纯化或切向流过滤 (TFF) 纯化的IVT mRNA 可以进一步提高 mRNA 质量。现有 mRNA 疫苗的详细信息暂未披露,因此只能推测。
结合 LNP,修饰的 mRNA 现在是mRNA 疫苗平台的基础,该平台已被证明是最成功的,因为其最佳免疫反应源于 LNP 佐剂功能和修饰 mRNA 之间的折衷,从而提高了疗效和安全性。尽管 mRNA-LNP 平台提供了多种优势,但仍有改进的空间,我们可能会看到这项技术的进一步迭代。最近,在基于小鼠模型中产生的数据预测临床结果时发现了局限性,这些数据涉及由 mRNA 脂质复合物刺激 toll 样受体 (TLR) 7/8 诱导的全身炎症的下游效应。据报道,人类分泌促炎白细胞介素(IL)-1β,而小鼠上调IL-1受体拮抗剂的诱导以控制炎症。该领域的另一个挑战是脂质成分本身可能会激活免疫反应,这可能因成分和配方的类型而异。在一项比较 LNP 和 lipoplexes 的研究中,发现细胞因子诱导存在差异,这表明 LNP 制剂的可电离脂质可能是原因。考虑到这一点,未来对应用后 mRNA 免疫下游效应的研究可能会影响mRNA 的安全性,这需要仔细考虑,并且需要根据疾病仔细选择 mRNA 制剂的类型和组成。
除了线性mRNA,其它mRNA疫苗平台也受到关注。环状RNA 于 1976 年首次发现,后来在人体细胞中检测到。虽然最初认为它不能用作翻译模板,但后来的报道反驳了这一假设,引发了进一步的研究。它与线性 RNA 相比具有增强的生物稳定性,这是由于缺乏阻止降解的末端,基于此,环状RNA 可能是一个有前途的研究对象。另一种降低剂量水平的方法是使用能够自我扩增的 mRNA 平台。病毒生物学研究了推动在抗原编码序列旁边插入 RNA 依赖性 RNA 聚合酶 (RdRp) 序列,从而导致目的抗原在细胞质中的扩增。随着目的抗原的细胞内 RNA 复制,saRNA 可以在低剂量下导致高抗原产生。
Part 3 mRNA疫苗的免疫机制和SARS-CoV-2抗原的选择
使用 mRNA 疫苗进行免疫需要将编码抗原的 mRNA 转录物配制成 LNP,然后将其递送至抗原呈递细胞 (APC)(图 1)。LNP-mRNA 被内吞并通过内体逃逸到细胞质的过程释放,在这里,目标抗原产生并由转染细胞(包括肌肉细胞和 APC)作为膜结合抗原呈递,导致 B 细胞、CD4+ 的激活辅助 T 细胞和CD8+ 细胞毒性 T 细胞反应(图 1)。生发中心 B 细胞反应及其对 CD4+ T 滤泡辅助 (Tfh) 细胞的调节对于高亲和力中和抗体滴度和持久 B 细胞反应至关重要。Tfh 细胞识别 APC 表面上的抗原并帮助激活 B 细胞,进而产生高亲和力的病毒中和抗体。最近,发现 LNP-mRNA 疫苗的 LNP 成分具有佐剂活性,这取决于其可电离的脂质成分和 IL-6 细胞因子诱导。这种 LNP 驱动的佐剂活性诱导强烈的 Tfh 细胞反应和体液免疫,从而增强基于 mRNA 的疫苗的功效。Tfh 细胞进一步帮助激活可能特异性识别的 CD8+ 细胞毒性 T 细胞并消除病毒感染的细胞(图 1)。事实上,SARS-CoV-2 LNP-mRNA疫苗接种后会引发血液和引流淋巴结中持续的抗原特异性生发中心 B 细胞反应和浆母细胞反应,导致强大而持久的体液免疫的形成。
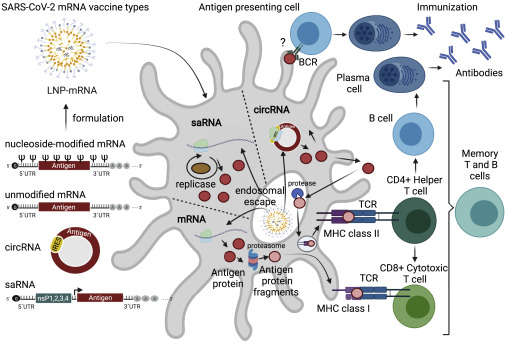
图注:使用 mRNA 疫苗针对COVID-19 进行免疫。使用 mRNA 疫苗进行免疫需要编码抗原的 mRNA 转录本。线性非复制 mRNA 由编码抗原(例如,SARS-CoV-2 的 S 蛋白)的序列组成,其两侧为 5' 和 3' UTR,在 5' 端具有帽结构,且在 3' 端有poly(A) 尾。基于在IVT 期间使用的天然或修饰的核苷,会产生未修饰或修饰的 mRNA。saRNA 由相同的序列结构组成,但另外包含:(1) 编码四种非结构蛋白 (nsP1-4) 的序列,它们形成负责 saRNA 扩增的复制酶,以及 (2) 病毒来源的亚基因组启动子(黑色箭头),启动抗原转录。用于疫苗应用的circRNA 由包含抗原序列的共价闭合单链 RNA 和允许启动抗原翻译的 IRES 组成。抗原编码 mRNA 被配制进入LNP,被内吞,并通过内体逃逸到细胞质的过程释放。S 蛋白由 APC 的翻译机制(红色圆圈)产生,被蛋白酶体降解(粉色圆圈),呈现在 MHC I 类(粉色圆圈)上,导致针对 SARS-CoV-的特定 CD8+ 细胞毒性 T 细胞反应。抗原也可以锚定在 APC 的膜上并被 BCR 直接识别,从而导致 B 细胞反应;然而,这种路径及其对抗体生产的贡献目前仍有争论。最后,抗原蛋白可以从细胞中输出并内吞回同一个或另一个 APC,被内体蛋白酶降解,并呈递在 MHC II 结构上,导致 CD4+ 辅助 T 细胞反应。随着CD4+ 辅助性 T 细胞进一步帮助 (1) 激活产生 SARS-CoV-2 中和抗体的 B 细胞和 (2) 激活可特异性识别和消除病毒感染细胞的 CD8+ 细胞毒性 T 细胞,形成免疫。APC,抗原呈递细胞;BCR,B细胞受体;circRNA,环状核糖核酸;IRES,内部核糖体进入位点;IVT,体外转录;LNP,脂质纳米颗粒;MHC,主要组织相容性复合物;mRNA,信使核糖核酸;saRNA,自扩增核糖核酸;SARS-CoV-2,严重急性呼吸综合征冠状病毒 2;S蛋白,刺突蛋白;TCR,T细胞受体;UTR,非翻译区。
SARS-CoV-2的整个表面刺突 (S)糖蛋白或 S 蛋白的受体结合结构域 (RBD),对病毒进入宿主细胞至关重要,代表了最广泛选择和最合适的COVID-19 疫苗开发抗原靶点。全长 S 蛋白和 RBD 本身都具有免疫原性,并在被免疫系统识别后诱导强烈的保护性中和抗体反应。通过引入已知保守的两个连续脯氨酸残基 (2P) 可改善免疫反应融合前构象中的全长 S 蛋白。S 蛋白被宿主细胞蛋白酶弗林蛋白酶切割成亚基(S1 和 S2),支持细胞进入。有趣的是,切割的 S1 的 C 端基序亚基可以与神经菌丝蛋白-1 (NRP-1) 结合,这会对 T 细胞记忆产生负面影响。因此,在疫苗开发中 S 蛋白的弗林蛋白酶切割位点的功能丧失修饰或缺失可能是有益的。
病毒抗原编码 mRNA 疫苗的功效受编码序列密码子优化的影响,且不仅与稳定性和可翻译性有关。最近的一项研究表明,源自 SARS-CoV-2 感染期间的框外开放阅读框翻译的隐蔽表位可以在密码子优化期间被修改或丢失,从而导致免疫原性反应增强或减弱。
本文为以下文献内容简介,详细内容,请参考原文。
原文:G.T.Szabo, A.J.Mahiny, I.Vlatkovic, COVID-19 mRNA vaccines: Platforms and current developments. Molecular Therapy, 2022, 30, 5.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..