9月16日,Marengo宣布其自主研发的T细胞激活剂STAR0602已获FDA批准开展临床,并预计将于今年Q4启动STAR0602单药治疗晚期实体瘤的I/II期临床试验。

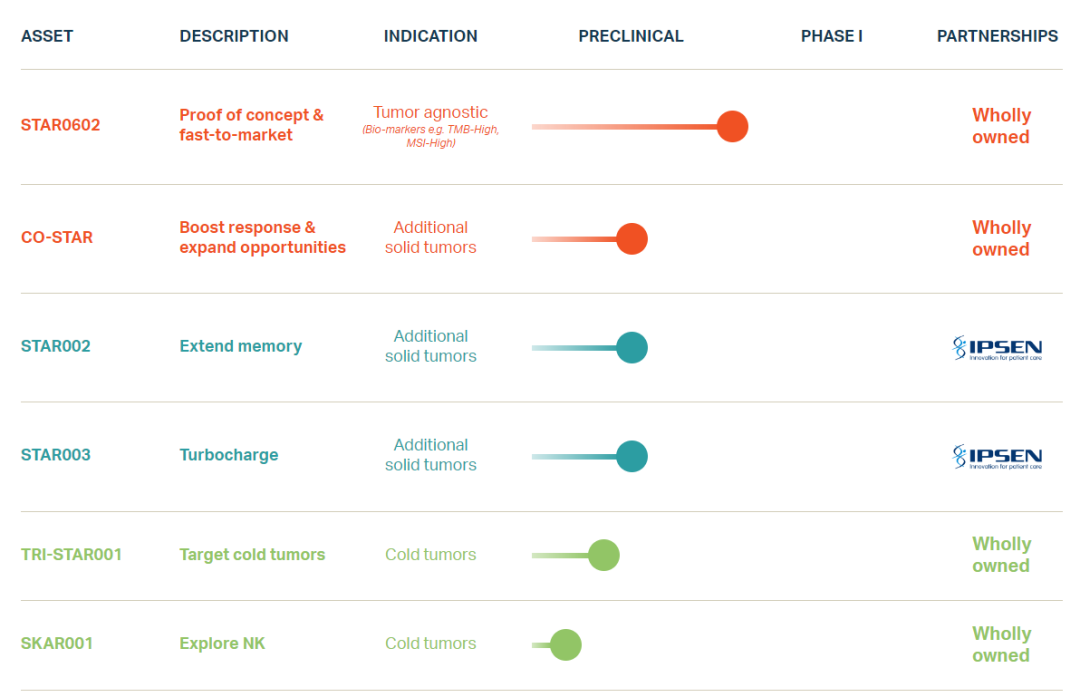
STAR0602项目是Marengo的主推项目,也是第一个由选择性T细胞激活库(STAR)平台生成的双特异性抗体融合分子,它能结合并激活特定的Vβ T细胞亚群,同时还能将共刺激信号传递至同一T细胞(称为顺式靶向),从而使该T细胞亚群选择性扩增。该产品已在临床前研究中证明了其治疗PD-1难治性肿瘤的单剂量有效性。
STAR平台是一个多特异性融合蛋白库,其靶向融合了不同的共刺激信号的特定TCR Vβ变体以开发有效的T细胞激活剂。该平台的独特之处在于微调特定T细胞亚群中的T细胞反应,以生成用于实体瘤的内源性、高功能、可杀伤癌细胞的T细胞。

此外,为了能够利用STAR平台进行STAR0602的临床开发并推进转化研究,Marengo已与美国国家癌症研究所(NCI)的癌症研究中心(CCR)和免疫肿瘤学中心(CIO)签订了合作研发协议(CRADA),这也是CIO的第一个CRADA。NCI与Marengo将合作开展选择性免疫激活抗体库的临床前和临床研究,以将其开发用于癌症和其他T细胞相关疾病。
目前,Marengo管线中共6款在研产品,STAR0602是唯一一款进入临床阶段的产品。
Marengo首席执行官苏振博士说:“将我们的主要产品推进临床标志着Marengo的一个关键转折点——我们开始将候选产品转化为挽救生命的药物。与NCI的合作将帮助我们加快临床试验的注册,同时确保它按照最高的道德和质量标准执行。我们真的很荣幸成为CIO的第一个CRADA合作伙伴,并期待将我们的专业知识与Gulley博士、Schlom博士及其团队的专业知识相结合,为患者创造有重大转变的免疫疗法。作为CRADA的一部分进行的研究将为我们的主要产品和STAR平台带来更多的机会,以解决高度未满足的医疗需求。”
此前,Marengo于今年8月与益普生建立战略合作伙伴关系,授予后者STAR002和STAR003的临床开发权。此次合作将利用Marengo在T细胞活化的新机制方面的专有研发技术及益普生的全球肿瘤中心进行临床开发和商业化。
根据协议条款,益普生将向Marengo支付4500万美元的预付款。此外,如果达到所有里程碑,则将支付除分级销售特许权费用外高达15.92亿美元的额外里程碑付款。Marengo将主导临床前开发工作并承担相关研发成本,直到向FDA提交药物临床试验(IND)申请。益普生将承担临床开发和商业化的责任。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..