今日,Axsome Therapeutics公司宣布,美国FDA已经批准Auvelity(右美沙芬+安非他酮)缓释片上市,用于治疗抑郁症(MDD)成人患者。新闻稿指出,Auvelity是60多年来,首款具有新作用机制的抑郁症口服疗法。它的问世有望给抑郁症患者提供一种起效迅速的新治疗选择。
抑郁症是一种常见的严重心理疾病,根据世界卫生组织(WHO)的统计,全球约有2.8亿患者,而且患者人数正在不断增加。据WHO今年3月发布的科学简报,在COVID-19大流行的第一年,全球焦虑症和抑郁症患病率增加了25%。抑郁症被WHO列为导致全球残疾的最主要原因之一,它不但影响患者的社会功能,严重情况下还会导致住院以及自杀。
此前所有获批的口服抗抑郁药物主要通过影响单胺类神经递质(包括5-羟色胺和去甲肾上腺素)的信号传播。然而,这些药物通常需要较长时间才能看到具有临床意义的应答,患者可能需要服药长达6-8周才能获得症状的缓解。而且,大多数患者在接受治疗后未能获得足够的缓解。63%的患者在一线治疗后未能进入缓解期(remission),他们迫切需要新的治疗选择。
Auvelity是一款创新口服NMDA受体拮抗剂,它具有多重作用机制。它包含右美沙芬和安非他酮两种成分。右美沙芬是一种非竞争性NMDA受体拮抗剂,它同时也是sigma-1受体激动剂。这代表了有别于此前获批口服疗法的一种新作用机制。安非他酮用于防止右美沙芬的降解,提高它在血液中的水平和半衰期。Auvelity曾经获得美国FDA授予的突破性疗法认定和优先审评资格,用于治疗抑郁症。
Auvelity的疗效和安全性在包含超过1100名抑郁症患者的临床开发项目中得到验证。在名为GEMINI的3期临床试验中,接受Auvelity治疗的抑郁症患者与安慰剂组相比,评定抑郁症状的MADRS量表评分在第6周时获得显著改善。
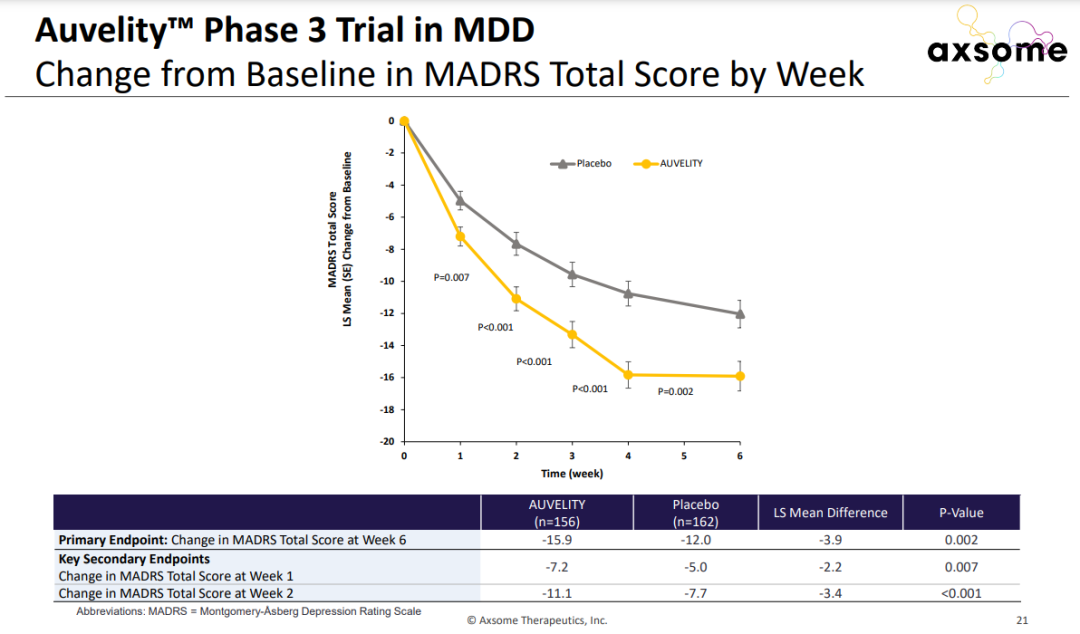
▲Auvelity在3期临床试验中显著改善患者抑郁症状(图片来源:参考资料[2])
值得一提的是,在接受治疗1周之后,患者的抑郁症状就获得了显著改善。接受治疗2周后,进入缓解期的患者比例是安慰剂组的两倍以上。
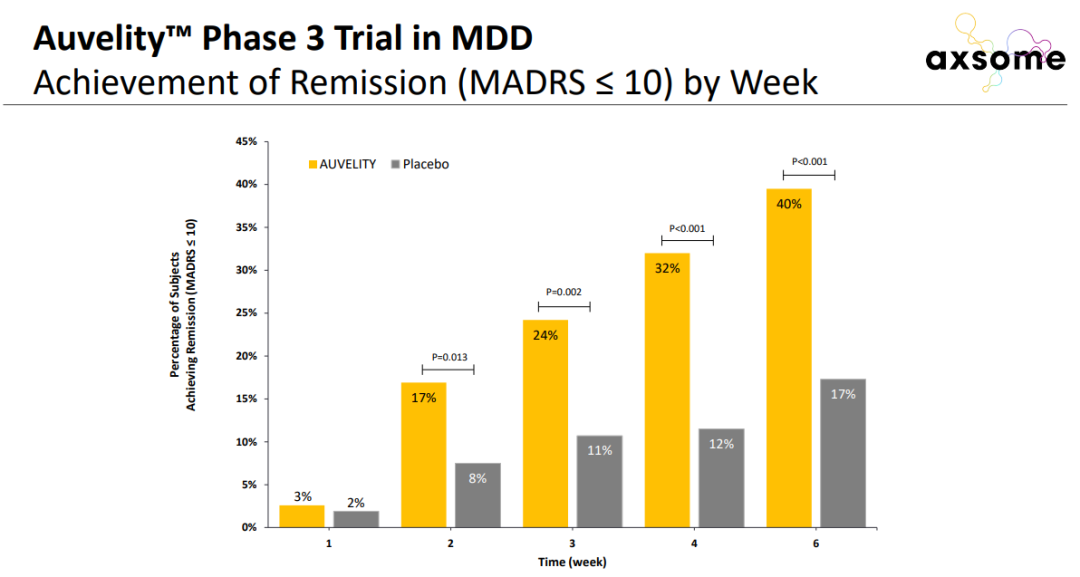
▲更多患者在接受Auvelity治疗后进入缓解期(图片来源:参考资料[2])
在含安慰剂对照的临床研究中,与Auvelity相关的最常见不良反应包括头晕、头痛、腹泻、嗜睡、口干、性功能障碍和多汗。
获批治疗抑郁症之外,这款创新疗法还获得FDA授予的突破性疗法认定,用于治疗阿尔茨海默病患者的激越(agitation)症状,目前3期临床试验正在进行中。
麻省总医院的精神科医生Maurizio Fava博士表示:“Auvelity的批准代表着抑郁症治疗领域的一个里程碑。它具有口服NMDA拮抗剂的创新作用机制,经临床试验证明的快速抗抑郁效果,和相对良好的安全性特征。Auvelity代表着超过60年来,首款不基于单胺类神经递质的抑郁症口服疗法。Auvelity在用药一周后就能观察到效果并且持续产生疗效,它可能对抑郁症的治疗模式产生显著影响。”
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..