美国FDA于1992年设立了加速批准(accelerated approvals,AA)程序,允许一个新药根据替代终点“附条件”批准上市,以满足一些重要疾病的临床治疗需求。但是,新药上市后需在确证性临床试验中证明可以改善患者的生存获益,才能转为完成批准(full approval),否则就有“撤回”上市资格的可能。
根据官网的公开资料,2022年上半年,FDA共撤回了6个肿瘤AA适应症,涉及5个产品,且基本集中在血液肿瘤领域,这是怎么回事呢?让我们一探究竟。
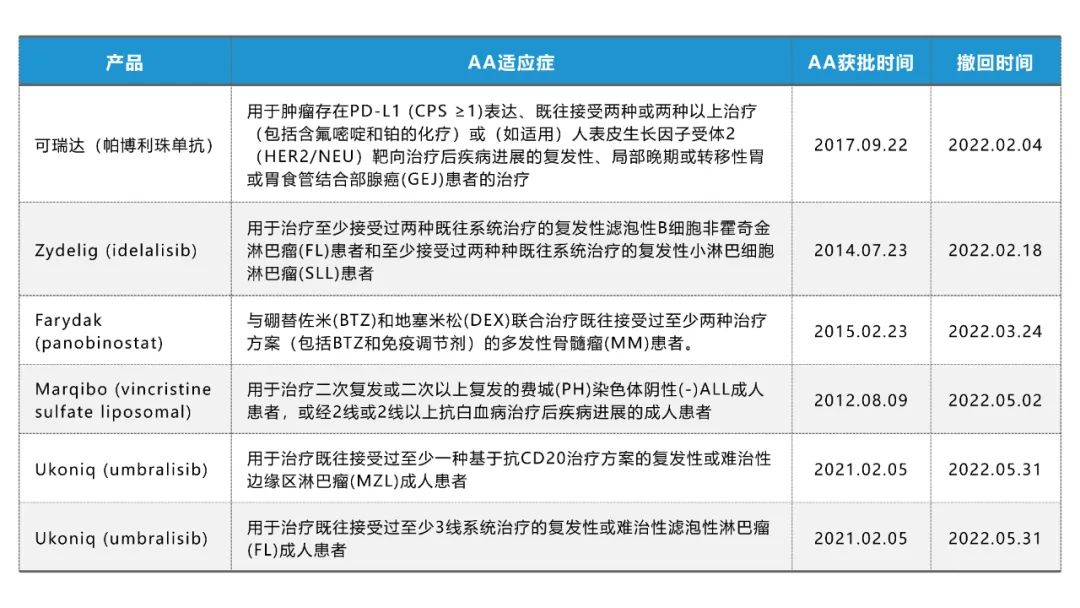
可瑞达(帕博利珠单抗)
AA批准:2017年9月22日,FDA加速批准帕博利珠单抗(pembrolizumab)用于经FDA批准的检测方法确定肿瘤表达PD-L1的复发性局部晚期或转移性胃或胃食管交界处腺癌患者。患者既往接受过2种或2种以上系统治疗[ 包括含氟嘧啶和铂类药物化疗以及HER2/neu-靶向治疗(如适用)] 期间或之后发生疾病进展。
批准是基于KEYNOTE-059研究的结果,KEYNOTE-059研究是一项开放标签、多中心、非比较、多队列试验,招募了259名胃或胃食管连接部腺癌患者,其中55%(n=143)PD-L1阳性表达且微卫星稳定(MSS)或微卫星不稳定性(MSI)或错配修复(MMR)状态未确定。这在143名肿瘤表达PD-L1阳性的患者中,客观缓解率为13.3%,1.4%完全缓解,11.9%有部分缓解。在19名缓解的患者中,缓解持续时间范围为2.8+至19.4+个月,11例患者(58%)的缓解持续时间为6个月或以上,5例患者(26%)的缓解持续时间为12个月或以上。在入组259例患者中,7例(3%)的肿瘤被确定为MSI-H。在这7例患者中的4例(ORR 57%)中观察到缓解,1例完全缓解。缓解持续时间范围为5.3+至14.1+个月。胃癌患者中发生的不良反应与既往一致。
撤回过程:2021年4月29日,肿瘤药物咨询委员会(ODAC)对帕博利珠单抗作为单一疗法的三线胃癌适应症进行评估,认为未能满足其上市后在一项Ⅲ期研究中证明总生存期获益的要求并以6:2的投票结果反对继续维持该适应症的AA。2021年7月1日,默沙东宣布自愿启动该适应症的撤回程序。
在KEYNOTE-059之后,帕博利珠单抗胃癌二线治疗KEYNOTE-061及一线治疗KEYNOTE-062的关键Ⅲ期临床试验接连失败。因此,当时FDA质疑帕博利珠单抗在胃癌中的临床获益。但2021年5月5日,FDA基于KEYNOTE-811的结果加速批准帕博利珠单抗联合曲妥珠单抗和铂类+氟尿嘧啶类化疗药物用于HER2+局部晚期不可切除或转移性胃或胃食管交界处腺癌患者的一线治疗。这也继纳武利尤单抗+化疗被批准用于胃癌一线治疗的又一免疫疗法。
Zydelig (idelalisib)
AA批准:2014年7月3日,吉利德的idelalisib获FDA的加速批准,用于治疗复发性滤泡性B细胞非霍奇金淋巴瘤(FL)和复发性小淋巴细胞白血病(SLL)。idelalisib是FDA批准的第一个用于B细胞血癌的PI3Kδ抑制剂药物。批准是基于一项惰性非霍奇金淋巴瘤的2期研究结果(研究101-09;NCT01282424),该研究显示54%的FL患者和58%的SLL患者经独立审查委员会评估达到客观缓解。
撤回过程:2022.1.14,吉利德宣布自愿撤回撤回idelalisib这两项适应证,原因是其未能完成FDA要求的确证性试验。这两种惰性非霍奇金淋巴瘤亚型的治疗格局已经发生了变化。基于肿瘤对药物反应的临床二期数据,吉利德获得了FL和SLL的加速批准。但之后出现的药物已经公布了更成熟的临床疗效数据。2021年4月,拜耳公布,其PI3K抑制剂copanlisib与利妥昔单抗(rituximab)一起使用,与单独使用利妥昔单抗相比,在已经接受过一种先前治疗的惰性非霍奇金淋巴瘤患者中,疾病进展或死亡的风险降低了48%。拜耳希望利用新的三期数据,将copanlisib对滤泡性淋巴瘤三线治疗的加速审批转为全面获批。
Farydak (panobinostat)
AA批准:2015年2月23日,FDA已批准诺华公司panobinostat联合硼替佐米和地塞米松用于既往接受至少2种治疗方案(包括硼替佐米和一种免疫调节药物)治疗失败的多发性骨髓瘤(MM)患者。panobinostat是用于治疗MM的首个组蛋白脱乙酰酶(HDAC)抑制剂。
panobinostat通过FDA的加速批准是基于一项全球III期临床研究(PANORAMA-1)中一项预定义亚组分析(n=193)的疗效和安全性数据。数据显示,在既往接受硼替佐米和一种免疫调节药物治疗的MM群体中,联合标准治疗方案(硼替佐米+地塞米松)治疗时,与安慰剂(PFS=5.8个月,n=99)相比,panobinostat延长了中位无进展生存期(PFS=10.6个月,n=94)。此外,panobinostat治疗组有59%的患者在治疗后肿瘤缩小或消失,而安慰剂组数据为41%。panobinostat可能会引起严重的副作用,包括腹泻和心脏问题。25%的panobinostat治疗患者发生严重腹泻。接受panobinostat的患者发生了严重和致命的心脏缺血事件,包括严重心律失常和心电图改变。60%接受panobinostat、硼替佐米和地塞米松治疗的患者发生严重不良事件(SAEs),而对照组为42%。
撤回过程:2019年3月5日,刚成立的创新公司Secura Bio宣布从诺华处收购panobinostat。但仅2年半的时间,就于2021年11月30日宣布,根据与FDA的讨论,Secura Bio已向FDA提交撤回对panobinostat的批准。Secura Bio在其撤回文件中指出,该公司无法完成确证性临床研究,panobinostat的临床益处未得到证实,目前panobinostat已在美国停产。panobinostat的起初上市的时候就曾因严重不良反应遭到ODAC的拒绝,后因诺华提交了额外的分析数据,同时修改panobinostat适应症才得以批准,可见本身就存在安全隐患。
Marqibo (vincristine sulfate liposomal)
AA批准:2012年8月9日,FDA批准Marqibo(vincristine sulfate liposomal,硫酸长春新碱脂质体)用于治疗用于治疗二次复发或二次以上复发的费城染色体阴性(PH-)急性淋巴细胞白血病(ALL)成人患者,或经2线或2线以上抗白血病治疗后疾病进展的成人患者,但FDA的批准非常勉强,ODAC是以7:4票(2票弃权)投票结果通过的批准。
FDA是基于包括148例患者的三项试验评估该药的安全性和有效性。其中一项多中心关键性临床II期试验中,65名曾接受两次或以上标准疗法而又复发的白血病患者显示了良好效果,其中至少一种前期疗法持续了90天甚至更长时间才有效果。受试者中有10名患者15.4%完全缓解,其伴随或不伴随血细胞数量不完全恢复的中位期为28天,复发、死亡或接受下一次治疗首次出现的中位时间为56天。在两项单臂安全性评价试验中,常见副反应为便秘、恶心、血细胞减少、发热、神经损伤、疲劳、腹泻、食欲降低和失眠。76%患者出现严重副作用,包括伴随发热的白细胞降低、低血压、呼吸窘迫和心脏骤停。
撤回过程:2021年10月27日,FDA与Acrotech公司约谈,讨论原定计划2021年12月2日召开的ODAC会议。FDA建议申请人自愿要求撤回对Marqibo的批准,因为缺乏临床益处的确证。上市后需确证性临床试验获尚未完成,并且由于治疗标准的改变,招募患者具有重大挑战。2021年11月19日,Acrotech提交申请自愿撤回适应症批准,并放弃听证会的机会。
Ukoniq (umbralisib)
AA批准:2021年2月5日,umbralisib获FDA加速批准上市,用于治疗之前至少接受过一种基于抗CD20治疗方案的复发或难治性边缘区淋巴瘤(MZL)成人患者和之前至少接受过三线全身治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。当时,umbralisib是首个也是唯一一个获批上市的口服的磷酸肌PI3Kδ和CK1ε抑制剂。
MZL和FL适应症的加速获批是基于一项II期UNITY-NHL研究的总缓解率(ORR)数据。UNITY-NHL研究是一项开放标签,多中心,双队列研究,2个队列分别招募了69例 MZL患者和117 例FL患者,受试者接受每日口服1次umbralisib(800mg)治疗,直至疾病进展或不可耐受毒性。研究结果表明,MZL患者的总缓解率(ORR)为49% ,完全缓解率(CR)为16%,中位缓解持续时间(DOR)尚未达到。FL患者ORR为43%,CR为3.4%,DOR为11.1个月。针对3项单臂、开放标签试验和1项开放标签扩展试验的221例MZL和FL成年患者安全性数据分析结果显示,接受umbralisib治疗的患者中有18%发生了严重不良反应,发生率>2%的严重不良反应包括:腹泻-结肠炎(4%)、肺炎(3%)、脓毒症(2%)和尿路感染(2%)。
撤回过程:2022年6月1日,FDA撤销了对umbralisib的加速批准,因为担心该药的使用可能会增加死亡风险。在umbralisib与的ublituximab联用治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞白血病(SLL)患者的III期临床试验UNITY-CLL研究中,这种死亡风险和其他不良副作用更加明显。FDA已要求医生停止开umbralisib处方,选用其他治疗方法。FDA还敦促医生告知目前正在服用umbralisib的患者,在临床试验中发现该药会增加死亡风险,并建议他们停止服用。
2022年4月21日,ODAC以16:0(1票弃权)的投票结果认为未来批准PI3K抑制剂,应基于随机数据而不是单臂试验。目前为止,FDA基于单臂数据批准了4种PI3K抑制剂用于血液系统恶性肿瘤的治疗,分别是:Zydelig(idelalisib),Aliqopa(copanlisib),Copiktra(duvelisib),Ukoniq (umbralisib)。这4种药物均显示出ORR或PFS的改善。但是,6项上市后随机对照试验结果显示,OS可能受到损害,同时可能出现严重且致命的不良反应。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..