免疫学是礼来公司内部最年轻的业务部门,但该公司预计在未来几年内将成为该领域重要的参与者。
礼来于2021年剥离其免疫学业务部门时,该公司对该领域做出了长期承诺,并表示至少在未来十年或几十年拥有一系列产品。
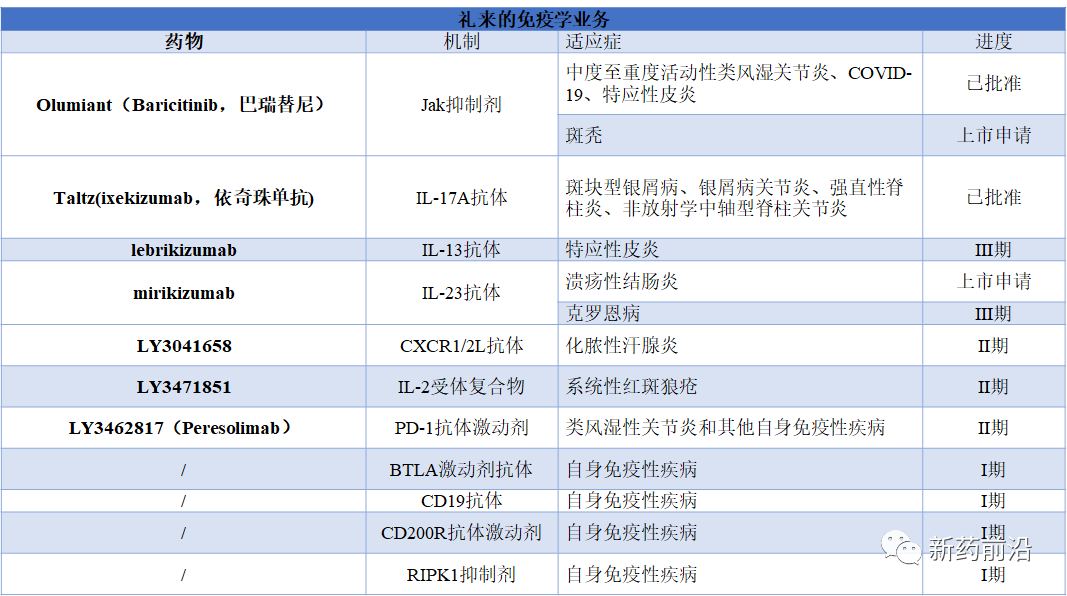
其实,回看2021年全球制药公司自身免疾病业务,礼来在该领域的业务收入为33.43亿美元,占公司总收入的12%,已经跻身全球前十。
礼来公司目前的免疫学领域主要围绕三个有前景的热点项目:类风湿性关节炎和COVID-19药物Olumiant(Baricitinib,巴瑞替尼),而且该药斑秃(脱发)适应症正在接近批准;与此同时,mirikizumab正在寻求治疗溃疡性结肠炎的机会,有可能成为第一个获批用于治疗巨大未满足需求的疾病的IL-23抑制剂。最后,lebrikizumab正在调整其在特应性皮炎中的作用,该抗体同样非常具有竞争力。
01
Olumiant
礼来与Incyte合作开发的Olumiant于2018年5月获得FDA批准上市用于治疗类风湿性关节炎;自2020年11月以来,Olumiant在美国已通过紧急使用授权(EUA)向需要补氧/有创机械通气/ECMO、年龄≥2岁的住院COVID-19成人和儿科患者提供治疗。
不过,Olumiant最大的市场潜力在于斑秃领域,礼来于2021年底在美国提交该适应症的上市申请,6月13日,FDA宣布批准Olumiant用于治疗成人重度斑秃。这是FDA批准的首个斑秃系统疗法。
值得一提的是,欧洲药品管理局人用药品委员会(CHMP)于今年5月支持Olumiant上市用于治疗严重斑秃成人患者。欧盟预计在1~2个月内做出最终决定。
今年3月,礼来及其合作伙伴Incyte在美国皮肤病学会年会上表示,Olumiant具有令人印象深刻的头发再生潜力。该公司当时报告称,在使用Olumiant治疗严重斑秃的成年人中,近75%的患者对4mg剂量的Olumiant有反应,在52周时头皮毛发覆盖率达到90%。
凭借来自两项Ⅲ期试验的一年数据,礼来预计将于今年年底前在美国、欧洲和日本获得Olumiant治疗斑秃的批准。
与此同时,礼来公司已经建立了强大的皮肤病学网络为Olumiant新适应症上市进行布局。
礼来在2022年初表示,该公司的被批准用于斑块型银屑病、银屑病关节炎和强直性脊柱炎的药物Taltz(ixekizumab,依奇珠单抗),去年全年销售额也达到了22亿美元。
礼来表示,斑秃非常适合公司目前的资源。该公司在皮肤病学方面拥有专业知识,无论是在开发方面,还是从面向客户推广。
需要指出的是,Olumiant向斑秃适应症发起上市冲击时,正值JAK抑制剂普遍受到全级别安全审查之际。尽管如此,鉴于斑秃的需求尚未得到满足,礼来公司认为监管机构将积极看待该药的风险收益状况。
除了Taltz之外,Olumiant已构成了礼来目前免疫疾病业务稳定收入的另一主要来源。在目前的适应症中,该药物在2021年全年的销售额约为11亿美元。
02
lebrikizumab
礼来还在其2020年的Dermira收购中获得了格隆铵外用溶液湿润剂Qbrexza,该药于2018年获得FDA批准用于治疗成人及9岁以上患者的原发性腋窝多汗症;更重要的是获得了后者特应性皮炎(AD)创新人源化抗白介素13(IL-13)单克隆抗体lebrikizumab。
去年礼来相续公布lebrikizumab单药治疗中重度特应性皮炎的三项Ⅲ期临床试验顶线结果,都达到主要终点和全部次要终点,安全性与先前一致。
预计三项关键Ⅲ期临床试验详细结果将于2022年获得,礼来计划在今年年底前提交lebrikizumab上市申请。
03
mirikizumab
礼来的mirikizumab是一种正在上市申请的免疫疾病药物。
礼来在一季度财报新闻稿中表示,该公司已经向FDA递交mirikizumab治疗中重度溃疡性结肠炎成人患者的上市申请。根据潜在的12个月审查时间,该药可能会在2023年获得批准。
mirikizumab是由礼来开发的一款人源化IgG4单克隆抗体,靶向结合IL-23的p19亚基。
2021年3月,礼来宣布该药在治疗中重度溃疡性结肠炎患者的的Ⅲ期临床试验中达到主要终点和关键性次要终点。
今年2月,礼来再次宣布,在针对中重度溃疡性结肠炎患者的Ⅲ期临床试验LUCENT-1研究中,有近2/3的患者在治疗12周时对mirikizumab有治疗反应。
对于有可能在2022年上市的斑秃适应症药物Olumiant,以及已提交上市申请的mirikizumab和有望年内提交上市申请的lebrikizumab,礼来将在免疫学领域迎来了自己的高光时刻。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..