2021年是党和国家历史上具有里程碑意义的一年。以习近平同志为核心的党中央团结带领全党全国各族人民,隆重庆祝中国共产党成立一百周年,胜利召开党的十九届六中全会、制定党的第三个历史决议,如期打赢脱贫攻坚战,如期全面建成小康社会、实现第一个百年奋斗目标,开启全面建设社会主义现代化国家、向第二个百年奋斗目标进军新征程。在“十四五”开局之年,作为我国负责药品注册上市的专职技术审评机构,国家药品监督管理局药品审评中心(以下简称药审中心)始终坚决贯彻落实习近平总书记重要讲话和重要指示精神,全面践行“四个最严”要求,牢记保护和促进公众健康初心使命,坚持人民至上、生命至上和科学审评,积极投身药品审评审批制度改革事业,紧紧围绕人民生命健康、世界科技前沿、国家重大需求等战略目标,在体制机制、技术标准、流程管理、队伍建设等方面加快创新融合步伐。
面对复杂严峻的疫情防控形势和极为艰巨繁重的药品审评任务,药审中心在国家药品监督管理局党组的坚强领导下,以习近平新时代中国特色社会主义思想为指导,深入学习贯彻党的十九届五中、六中全会精神和“七一”重要讲话精神,认真落实党中央、国务院决策部署,推动全面从严治党不断向纵深发展,认真开展好党史学习教育和“我为群众办实事”实践活动,全力推进新冠病毒疫苗药物应急审评审批,推动2款国产新冠病毒疫苗接连被纳入世界卫生组织(WHO)紧急使用清单(EUL),应急审评通过一组新冠病毒中和抗体联合治疗药物上市,着力建设公开透明的审评机制,多措并举支持儿童用药研发创新,人民获得感、幸福感、安全感显著增强。
2021年审评通过47个创新药,再创历史新高,临床急需境外新药上市持续加快,优先审评效率大幅提高,仿制药质量和疗效一致性评价工作扎实推进,临床试验管理跃上新台阶,核查检验协调机制更加通畅,实施药品电子通用技术文档申报,中国上市药品专利信息登记平台建设运行,完成中药“三方”抗疫成果转化,完善符合中医药特点的审评技术标准体系,支持和推动中药传承创新发展,持续深化ICH工作,保障国家药品监督管理局成功连任ICH管理委员会成员,发布87个技术指导原则,审评标准体系更加完备,流程导向审评体系更加科学,审评体系和审评能力现代化建设持续推进,医药产业创新能力和高质量发展进一步增强。
第一章 药品注册申请受理情况
(一)总体情况
1.全年受理情况
2021年,国家药品监督管理局药品审评中心(以下简称药审中心)受理注册申请11658件1,同比增长13.79%。
受理需技术审评的注册申请9235件,同比增长29.11%,包括需经技术审评后报送国家局2审批(以下简称技术审评)的注册申请2180件,需经技术审评后以国家局名义作出行政审批(以下简称审评审批)的注册申请7051件,需经技术审评后送国家药品监督管理局医疗器械技术审评中心、以医疗器械作用为主的药械组合(以下简称药械组合)产品的注册申请4件。
受理无需技术审评直接以国家局名义作出行政审批3(以下简称直接审批)的注册申请2423件。2017-2021年注册申请受理量详见图1。
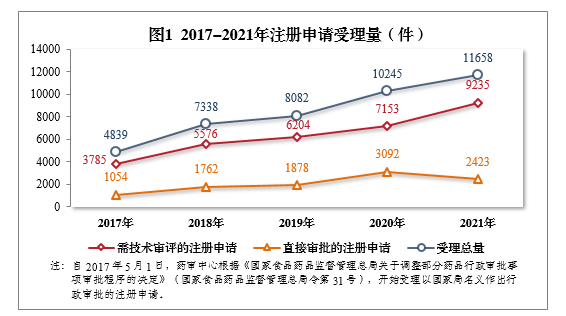
根据《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号,以下简称56号公告)要求,2021年受理原料药注册申请1313件,同比增长2.98%。
2.需技术审评的各类注册申请受理情况
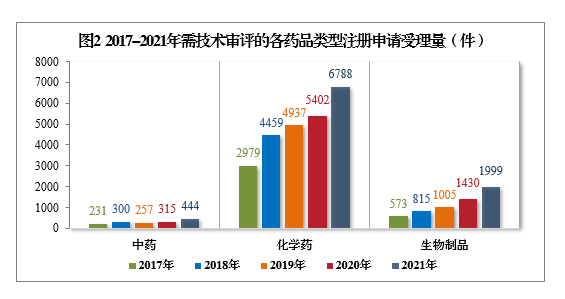
2021年受理的需技术审评的9231件4注册申请中,以药品类型统计,中药5注册申请444件,同比增长40.95%;化学药注册申请为6788件,同比增长25.66%,占全部需技术审评的注册申请受理量的73.53%;生物制品注册申请1999件,同比增长39.79%。2017-2021年需技术审评的各药品类型注册申请受理量详见图2。
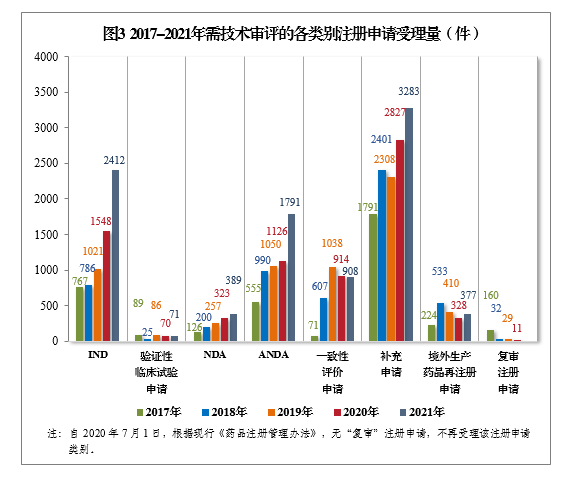
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称IND)2412件,同比增长55.81%;新药上市许可申请(该注册申请类别以下简称NDA)389件,同比增长20.43%;同名同方药、仿制药、生物类似药上市许可申请(该注册申请类别以下简称ANDA)1791件,同比增长59.06%;仿制药质量和疗效一致性评价注册申请6(该注册申请类别以下简称一致性评价申请)908件;补充申请3283件,同比增长16.13%。2017-2021年需技术审评的各类别注册申请受理量详见图3。
(二)创新药注册申请受理情况
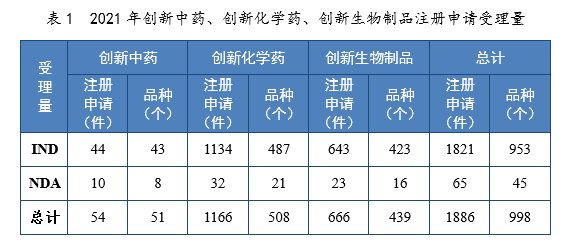
2021年受理创新药7注册申请1886件(998个品种8),同比增长76.10%。
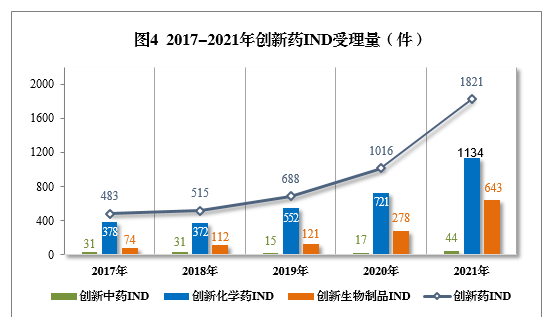
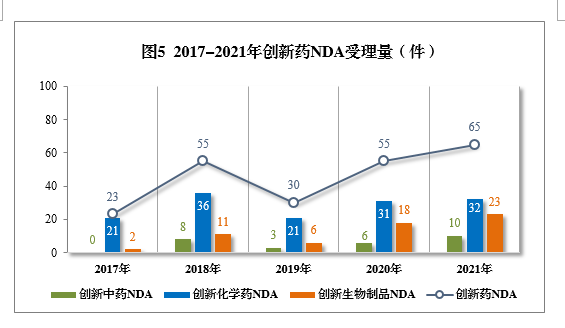
以药品类型统计,创新中药54件(51个品种),同比增长134.78%;创新化学药1166件(508个品种),同比增长55.05%;创新生物制品666件(439个品种),同比增长125.00%。
以注册申请类别统计,IND 1821件(953个品种),同比增长79.23%;NDA 65件(45个品种),同比增长18.18%。
2021年创新中药、创新化学药、创新生物制品注册申请受理量详见表1,2017-2021年创新药IND受理量详见图4,2017-2021年创新药NDA受理量详见图5。
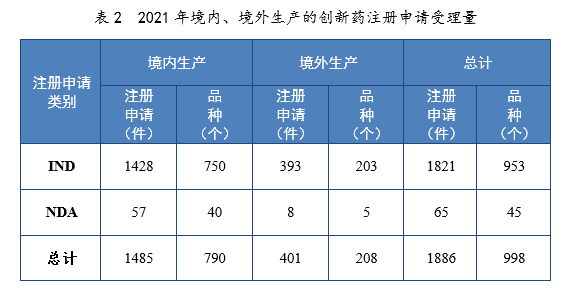
以生产场地类别统计,境内生产创新药1485件(790个品种),境外生产创新药401件(208个品种)。2021年境内、境外生产的创新药注册申请受理量详见表2。
(三)需技术审评的中药注册申请受理情况
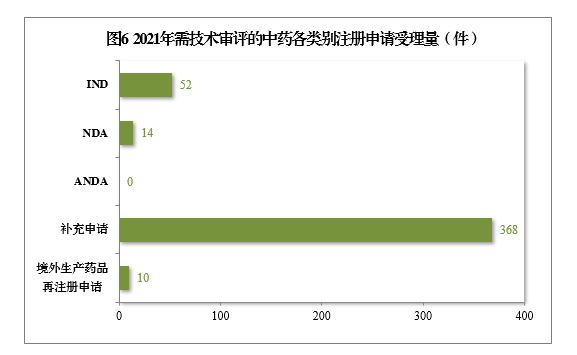
2021年受理需技术审评的中药注册申请444件。以注册申请类别统计,IND 52件,同比增长136.36%,包括创新中药IND 44件(43个品种),同比增长158.82%;NDA 14件,同比增长133.33%,包括创新中药NDA 10件(8个品种),同比增长66.67%。
2021年需技术审评的中药各类别注册申请受理量详见图6。2017-2021年需技术审评的中药各类别注册申请受理量详见图7。
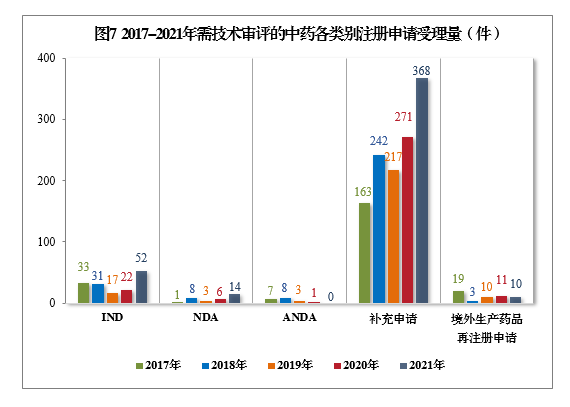
(四)需技术审评的化学药注册申请受理情况
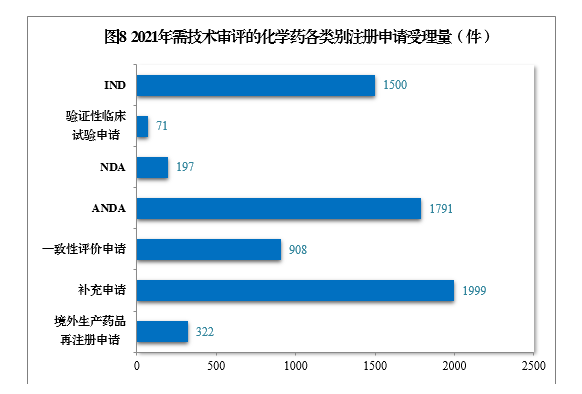
2021年受理需技术审评的化学药注册申请6788件。以注册申请类别统计,IND 1500件,同比增长58.56%,包括创新化学药IND 1134件(487个品种),同比增长57.28%;NDA 197件,同比增长3.14%,包括创新化学药NDA 32件(21个品种),同比增长3.23%;化学药5.1类9注册申请169件,同比增长5.63%,其中临床试验申请10共44件,NDA 125件;ANDA 1791件,同比增长59.20%;一致性评价申请908件。
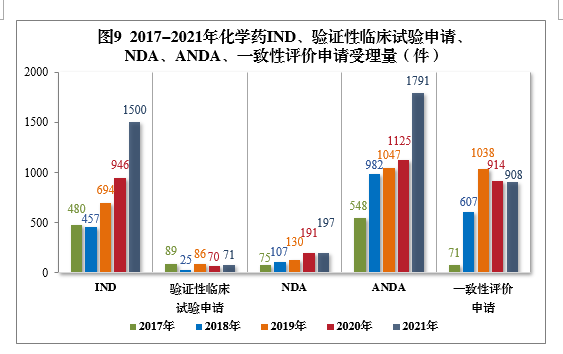
2021年需技术审评的化学药各类别注册申请受理量详见图8。2017-2021年化学药IND、验证性临床试验申请、NDA、ANDA、一致性评价申请受理量详见图9。
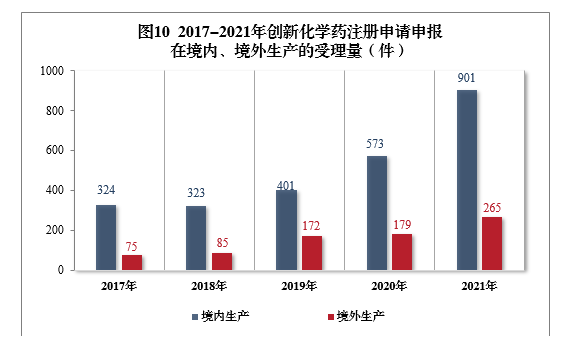
需技术审评的创新化学药注册申请共1166件(508个品种)11中,以生产场地类别统计,901件(385个品种)申报在境内生产,265件(123个品种)申报在境外生产。2017-2021年创新化学药注册申请申报在境内、境外生产的受理量详见图10。
(五)需技术审评的生物制品注册申请受理情况
2021年受理需技术审评的生物制品注册申请1999件,其中,预防用生物制品注册申请229件、治疗用生物制品注册申请1755件和体外诊断试剂15件。以注册申请类别统计:
IND 860件,同比增长48.28%,包括创新生物制品IND 643件(423个品种),同比增长131.29%。其中,预防用生物制品IND 45件,包括创新预防用生物制品IND 26件(16个品种),治疗用生物制品IND 815件,包括创新治疗用生物制品IND 617件(407个品种)。
NDA 178件,同比增长41.27%,包括创新生物制品NDA 23件(16个品种),同比增长27.78%。其中,预防用生物制品NDA 13件,包括创新预防用生物制品NDA 5件(2个品种);治疗用生物制品NDA 156件,包括创新治疗用生物制品18件(14个品种);体外诊断试剂9件。
补充申请916件。境外生产药品再注册申请45件。
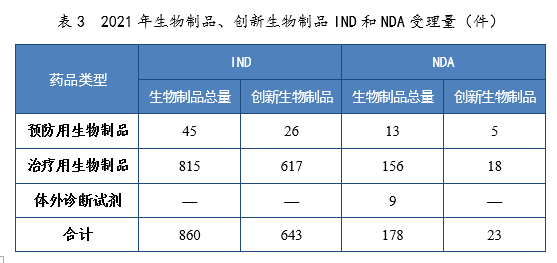
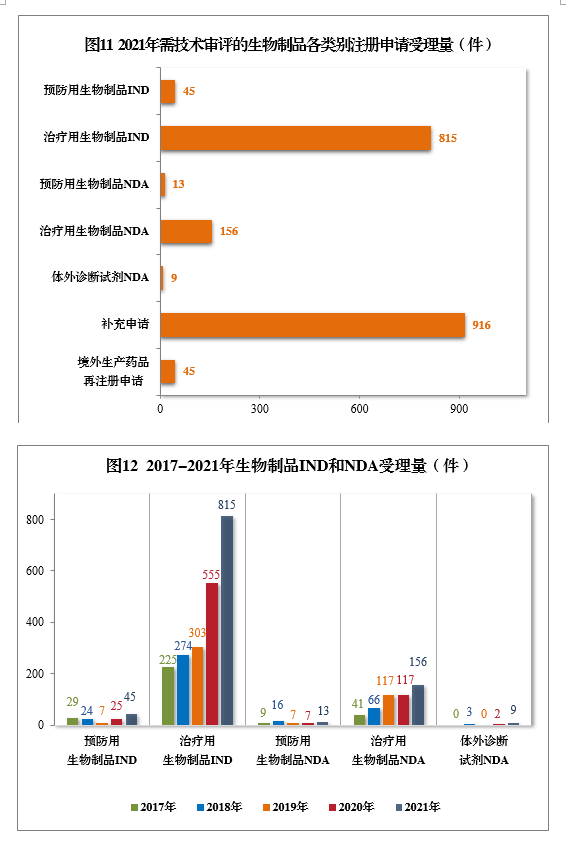
2021年生物制品、创新生物制品IND和NDA受理量详见表3。2021年需技术审评的生物制品各类别注册申请受理量详见图11。2017-2021年生物制品IND和NDA受理量详见图12。
表3 2021年生物制品、创新生物制品IND和NDA受理量(件)
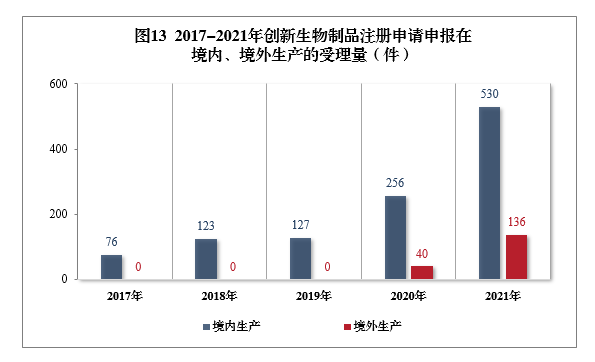
需技术审评的创新生物制品注册申请共666件(439个品种12)中,以生产场地类别统计,境内生产创新生物制品注册申请530件(354个品种),境外生产创新生物制品注册申请136件(85个品种)。2017-2021年创新生物制品注册申请申报在境内、境外生产的受理量详见图13。
(六)行政审批注册申请受理情况
1.总体情况
2021年受理行政审批注册申请9474件,同比增长7.82%。其中,直接审批的注册申请2423件;审评审批的注册申请137051件,同比增长23.81%,包括临床试验申请2483件,同比增长53.46%。
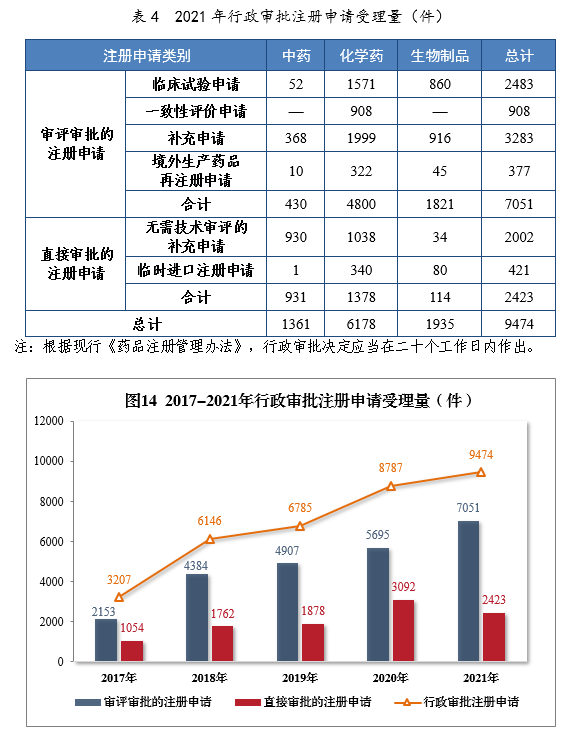
2021年行政审批注册申请受理量详见表4。201714-2021年行政审批注册申请受理量详见图14。
2.审评审批的注册申请受理情况
2021年受理审评审批的注册申请7051件,以药品类型统计,中药注册申请430件,同比增长40.07%;化学药注册申请4800件,同比增长17.50%,占全部审评审批的注册申请受理量的68.08%;生物制品注册申请1821件,同比增长39.75%。
以注册申请类别统计,临床试验申请2483件,同比增长53.46%;一致性评价申请908件;补充申请3283件,同比增长16.13%;境外生产药品再注册申请377件,同比增长14.94%。
3.直接审批的注册申请受理情况
2021年受理直接审批的注册申请2423件,以药品类型统计,中药注册申请931件、化学药注册申请1378件、生物制品注册申请114件。以注册申请类别统计,补充申请2002件、临时进口注册申请421件。
第二章 药品注册申请审评审批情况
(一)总体情况
1.全年审评审批工作情况
2021年审结的15注册申请共12083件16,同比增长19.55%。
审结的需技术审评的注册申请9679件,同比增长35.66%,包括技术审评的注册申请2632件,审评审批的注册申请7039件,药械组合注册申请8件。
审结直接审批的注册申请2404件。2017-2021年注册申请审结量详见图15。
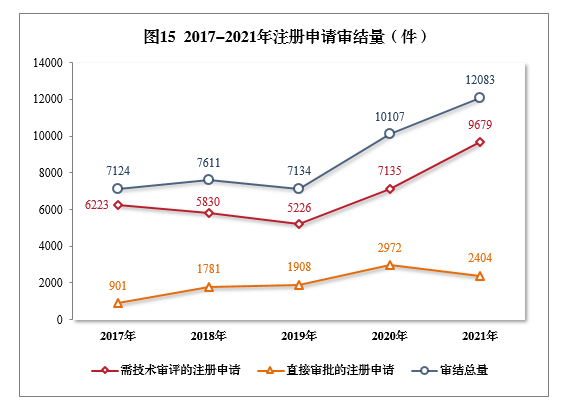
截至2021年底,有5652件注册申请正在审评审批中;待申请人回复补充资料1353件。根据56号公告,2021年审结原料药注册申请494件。截至2021年底,有1302件原料药注册申请正在审评审批中;待申请人回复补充资料582件。
2.需技术审评的各类注册申请审结情况
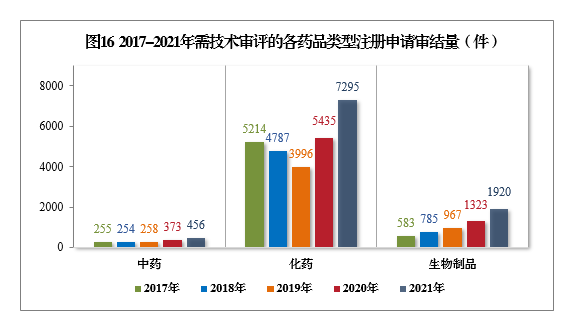
2021年审结的需技术审评的9671件17注册申请中,以药品类型统计,中药注册申请456件,同比增长22.25%;化学药注册申请7295件,同比增长34.22%,占全部需技术审评审结量的75.43%;生物制品注册申请1920件,同比增长45.12%。
2017-2021年需技术审评的各药品类型注册申请审结量详见图16。
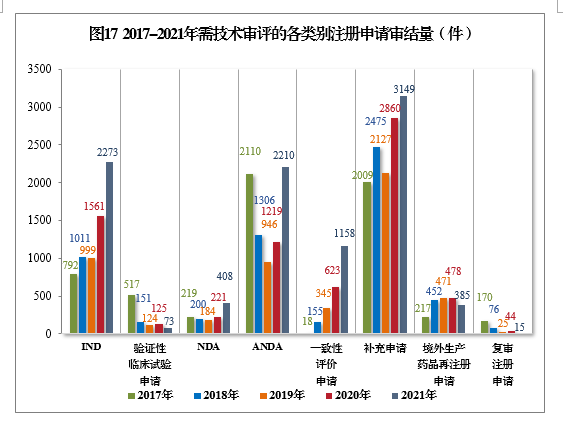
以注册申请类别统计,IND 2273件,同比增长45.61%;NDA 408件,同比增长84.62%;ANDA 2210件,同比增长81.30%;一致性评价申请1158件,同比增长85.87%;补充申请3149件,同比增长10.10%。2017-2021年需技术审评的各类别注册申请审结量详见图17。
3.批准/建议批准情况
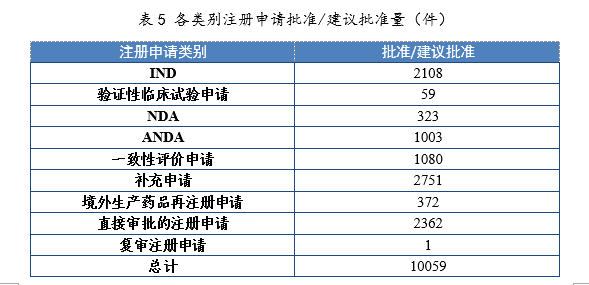
2021年批准IND 2108件,同比增长46.90%;建议批准NDA 323件(见附件1),同比增长55.29%;建议批准ANDA 1003件,同比增长9.26%;批准一致性评价申请1080件,同比增长87.18%。各类别注册申请批准/建议批准量详见表5。
建议批准境外生产原研药1876个品种(含新增适应症品种,见附件2)。
临床急需境外新药81个品种19中,截至2021年底,已有54个品种提出注册申请,51个品种获批上市,按审评时限审结率(以下简称按时限审结率)100%,临床急需境外新药审评审批情况见附件3。
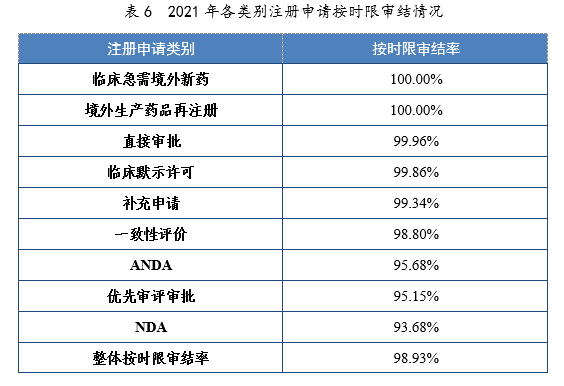
4.各类别注册申请按时限审结情况
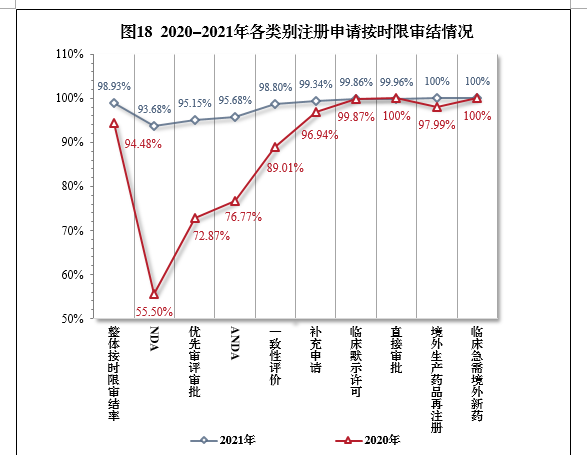
2021年,药审中心持续优化审评流程、严格审评时限管理、加快审评速度、强化项目督导,全年整体按时限审结率98.93%。其中NDA、ANDA、纳入优先审评审批程序的注册申请按时限审结率均超过90%,取得历史性突破。2021年各类别注册申请按时限审结情况详见表6,2020-2021年各类别注册申请按时限审结情况详见图18。
(二)创新药注册申请审结情况
1.总体情况
2021年审结创新药20注册申请1744件(943个品种),同比增长67.85%。
以药品类型统计,创新中药55件(55个品种),同比增长52.78%;创新化学药1085件(484个品种),同比增长45.44%;创新生物制品604件(404个品种),同比增长135.02%。
以注册申请类别统计,IND 1663件(885个品种),同比增长67.14%;NDA 81件(58个品种),同比增长84.09%。
2.批准/建议批准情况
2021年批准/建议批准创新药注册申请1628件(878个品种),同比增长67.32%。
以药品类型统计,创新中药39件(39个品种),同比增长39.29%;创新化学药1029件(463个品种),同比增长44.32%;创新生物制品560件(376个品种),同比增长141.38%。以注册申请类别统计,IND 1559件(831个品种),同比增长65.32%,NDA 69件(47个品种,见附件4),同比增长130.00%。
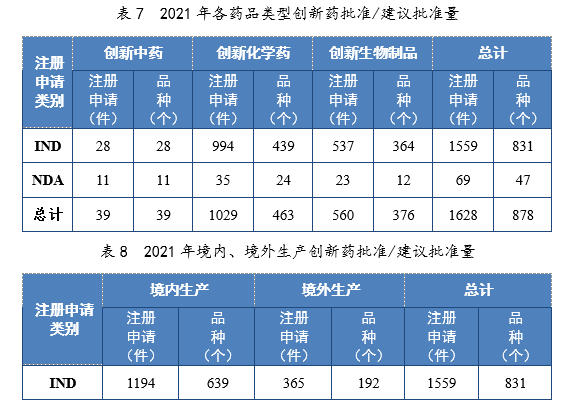
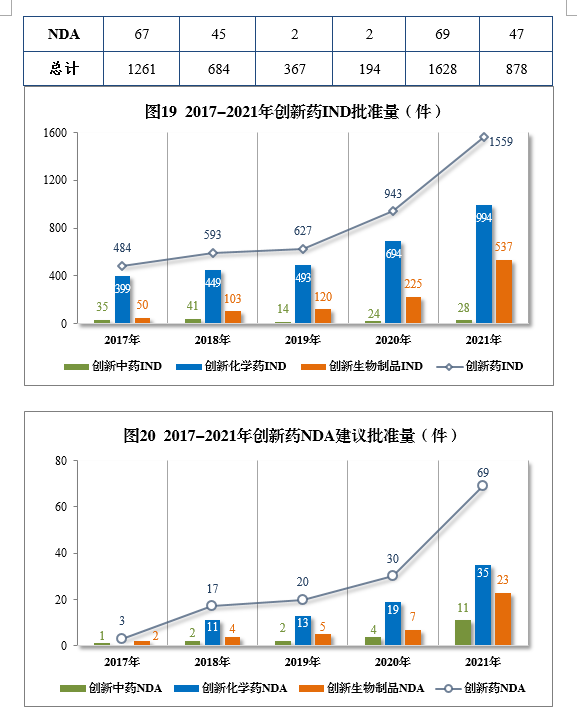
以生产场地类别统计,境内生产创新药1261件(684个品种),同比增长60.84%;境外生产创新药367件(194个品种),同比增长94.18%。2021年各药品类型创新药批准/建议批准量详见表7,2021年境内、境外生产创新药批准/建议批准量详见表8,2017-2021年创新药IND批准量详见图19,2017-2021年创新药NDA建议批准量详见图20。
(三)需技术审评的中药注册申请审结情况
1.总体情况
2021年审结需技术审评的中药注册申请456件,同比增长22.25%。以注册申请类别统计,IND 49件,同比增长32.43%;NDA 19件,同比增长216.67%;ANDA 3件。2021年需技术审评的中药各类别注册申请审结量详见图21。
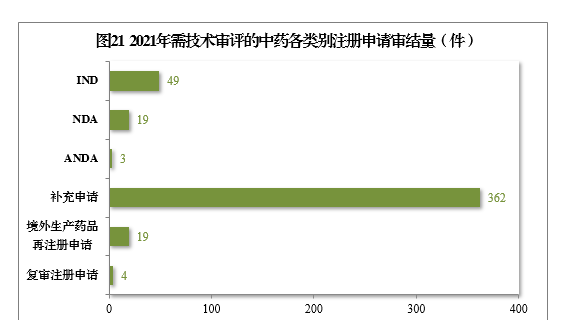
2.批准/建议批准情况
2021年审结的中药IND中,批准34件,不批准9件。审结的中药NDA中,建议批准14件,建议不批准3件。2021年需技术审评的中药注册申请审结情况详见表9。
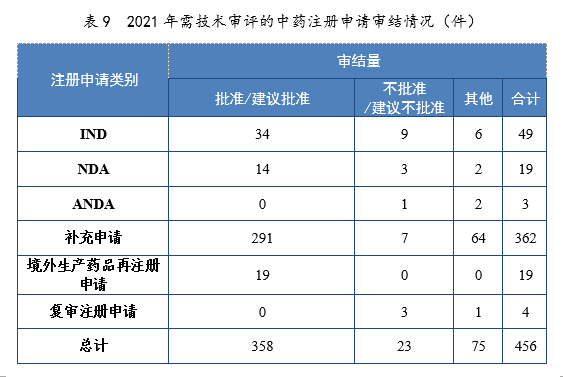
注:“其他”是指申请人未按规定缴纳费用、撤回申请等原因导致审评审批终止的情形。
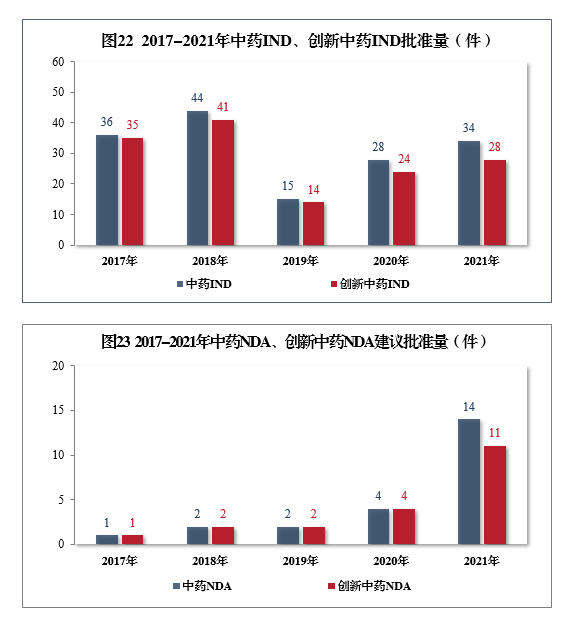
批准中药IND 34件,同比增长21.43%,包括创新中药IND 28件(28个品种),同比增长16.67%;建议批准中药NDA 14件,同比增长250.00%,创5年以来新高,包括创新中药NDA 11件(11个品种),同比增长175.00%。2017-2021年中药IND、创新中药IND批准量详见图22,2017-2021年中药NDA、创新中药NDA建议批准量详见图23。
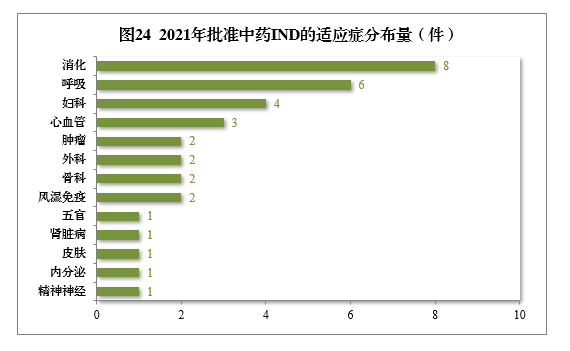
批准的34件中药IND中,涉及13个适应症领域,其中消化8件、呼吸6件、妇科4件,共占52.94%,2021年批准中药IND的适应症领域分布量详见图24。
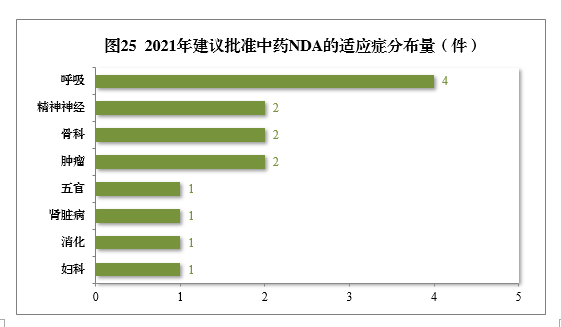
建议批准的中药NDA 14件中,呼吸肿瘤、精神神经、骨科药物较多,占全部中NDA批准量的71.43%。
2021年建议批准中药NDA的适应症分布量详见图25。
(四)需技术审评的化学药注册申请审结情况
1.总体情况
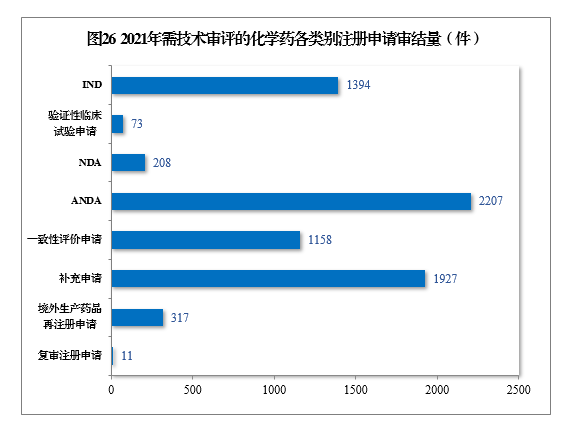
2021年审结需技术审评的化学药注册申请7295件。以注册申请类别统计,化学药临床试验申请1467件,同比增长35.21%;化学药NDA 208件,同比增长67.74%;化学药ANDA 2207件,同比增长81.50%;化学药一致性评价申请1158件,同比增长85.87%。2021年需技术审评的化学药各类别注册申请审结量详见图26。
2.批准/建议批准情况
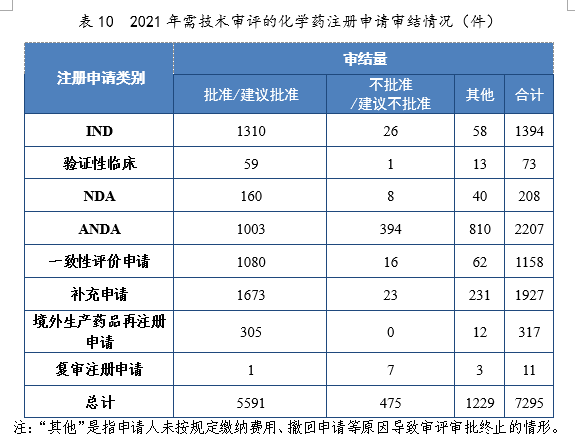
2021年审结的化学药IND中,批准1310件,不批准26件。审结的化学药NDA中,建议批准160件,建议不批准8件。审结的化学药ANDA中,建议批准1003件,建议不批准394件。2021年需技术审评的化学药注册申请审结情况详见表10。
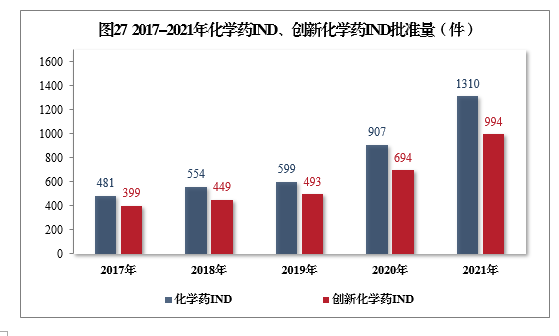
批准化学药IND 1310件,同比增长44.43%,其中创新化学药IND 994件(439个品种),同比增长43.23%。2017-2021年化学药IND、创新化学药IND批准量详见图27。
批准的化学药IND 1310件中,抗肿瘤药物、皮肤及五官科药物、循环系统疾病药物、消化系统疾病药物、内分泌系统药物、抗感染药物和神经系统疾病药物较多,占全部化学药IND批准量的83.21%。2021年批准化学药IND的适应症分布量详见图28。
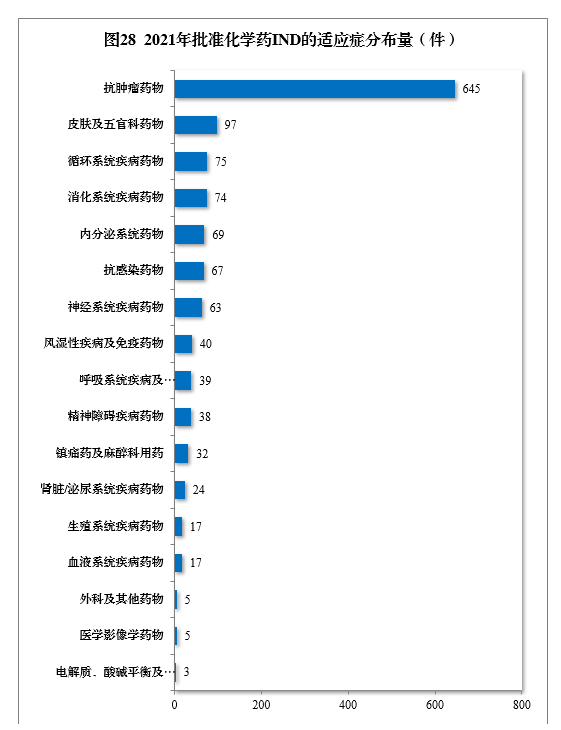
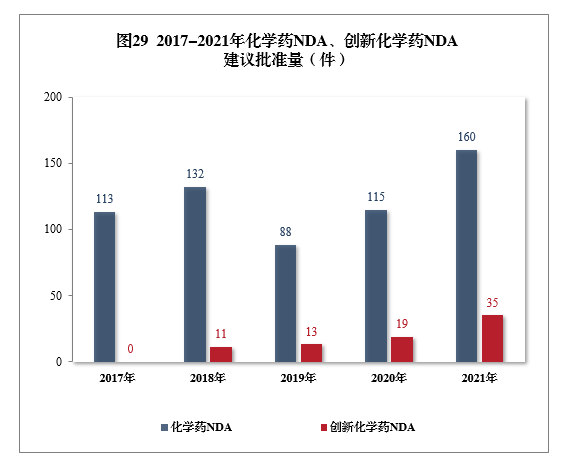
建议批准化学药NDA 160件,同比增长39.13%,包括创新化学药35件(24个品种),同比增长84.21%;建议批准化学药ANDA 1003件,同比增长9.26%。2017-2021年化学药NDA、创新化学药NDA建议批准量详见图29。
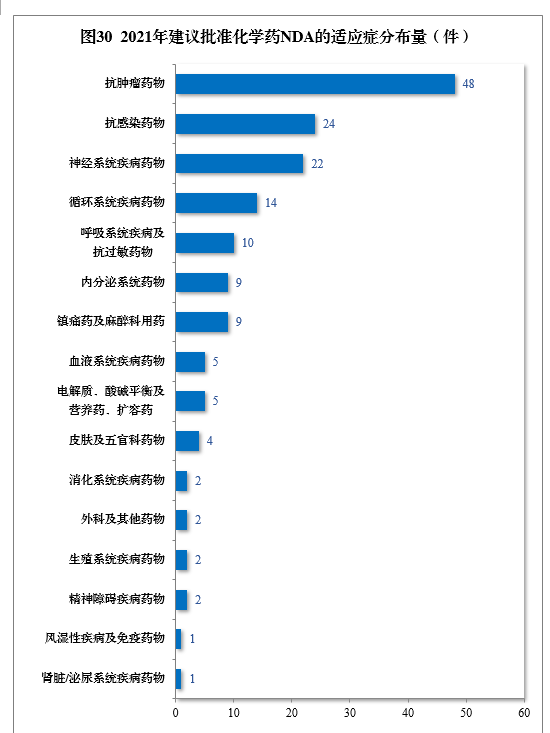
建议批准的化学药NDA 160件中,抗肿瘤药物、抗感染药物、神经系统疾病药物、循环系统疾病药物、呼吸系统疾病及抗过敏药物药物较多,占全部化学药NDA批准量的73.75%。2021年建议批准化学药NDA的适应症分布量详见图30。
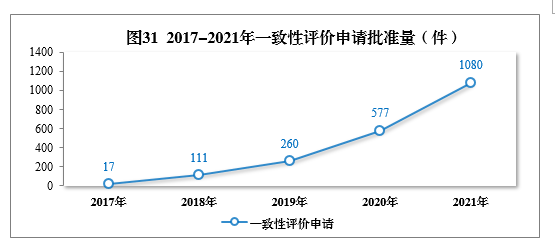
审结一致性评价申请共1158件,批准1080件。其中口服固体制剂一致性评价申请391件,注射剂一致性评价申请689件,2017-2021年一致性评价申请批准量详见图31。2021年批准的一致性评价品种见附件5。
(五)需技术审评的生物制品注册申请审结情况
1.总体情况
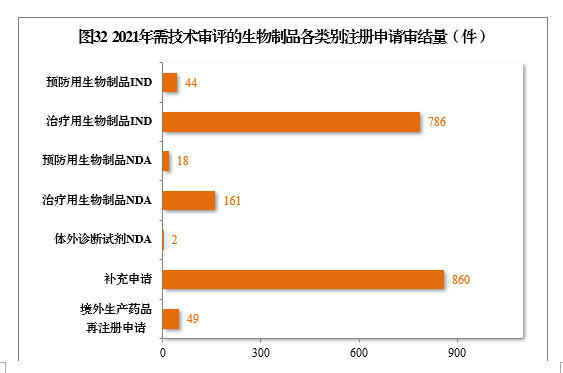
2021年,审结1920件需技术审评的生物制品注册申请,其中,预防用生物制品234件和治疗用生物制品1676件,体外诊断试剂10件。以注册申请类别统计,IND 830件,同比增长47.16%,NDA 181件,同比增长98.90%,补充申请860件,境外生产药品再注册申请49件。2021年需技术审评的生物制品各类别注册申请审结量详见图32。
2.批准/建议批准情况
2021年审结的生物制品IND中,批准764件,不批准34件。审结的生物制品NDA中,建议批准149件,建议不批准4件。2021年需技术审评的生物制品注册申请审结情况详见表11。
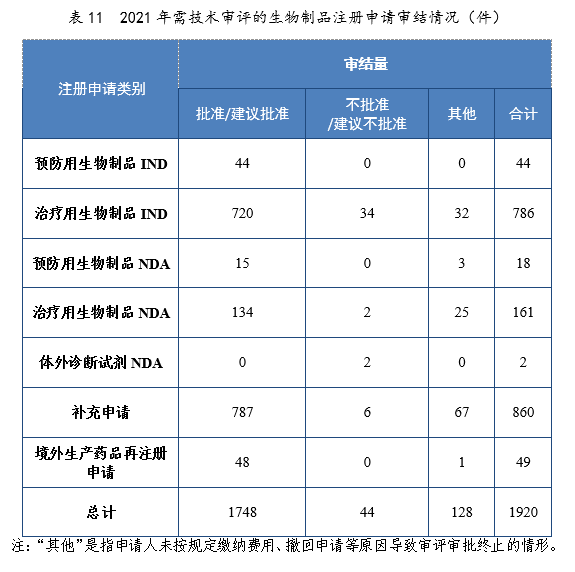
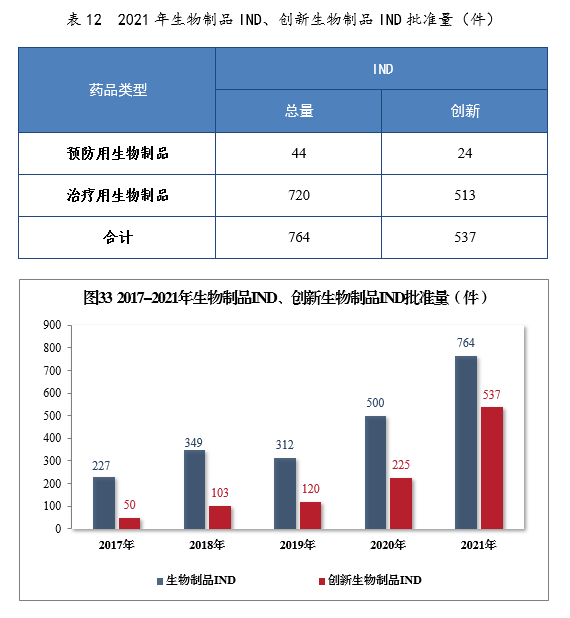
批准生物制品IND 764件,同比增长52.80%,包括创新生物制品IND 537件(364个品种),同比增长138.67%。其中,预防用生物制品IND 44件,同比增长131.58%,包括创新预防用生物制品IND 24件(16个品种),同比增长800%;治疗用生物制品IND 720件,同比增长49.69%,包括创新治疗用生物制品IND 513件(348个品种),同比增长131.08%。2021年生物制品IND、创新生物制品IND批准量详见表12。2017-2021年生物制品IND、创新生物制品IND批准量详见图33。
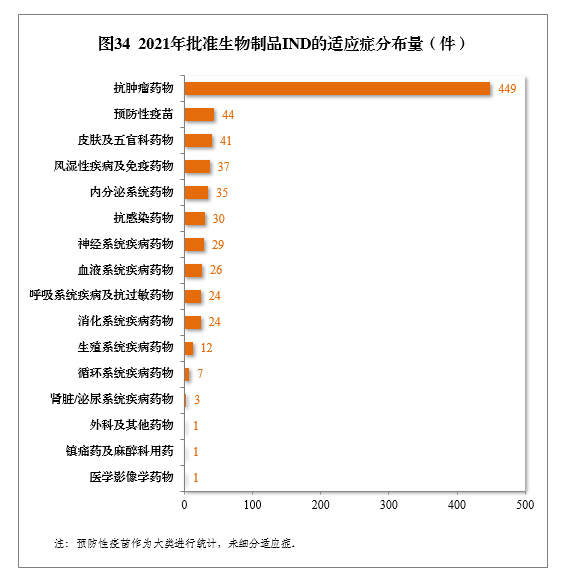
批准的生物制品IND 764件中,抗肿瘤药物较多,占全部生物制品IND批准量的58.77%。2021年批准生物制品IND的适应症分布量详见图34。
建议批准生物制品NDA 149件,同比增长67.42%,包括创新生物制品NDA 23件(12个品种),同比增长228.57%。其中,预防用生物制品NDA 15件,同比增长114.29%,包括创新预防用生物制品NDA 6件(3个品种);治疗用生物制品NDA 134件,同比增长65.43%,包括创新治疗用生物制品NDA 17件(9个品种),同比增长142.86%。2021年生物制品NDA、创新生物制品NDA建议批准量详见表13。2017-2021年生物制品NDA、创新生物制品NDA通过批准量详见图35。
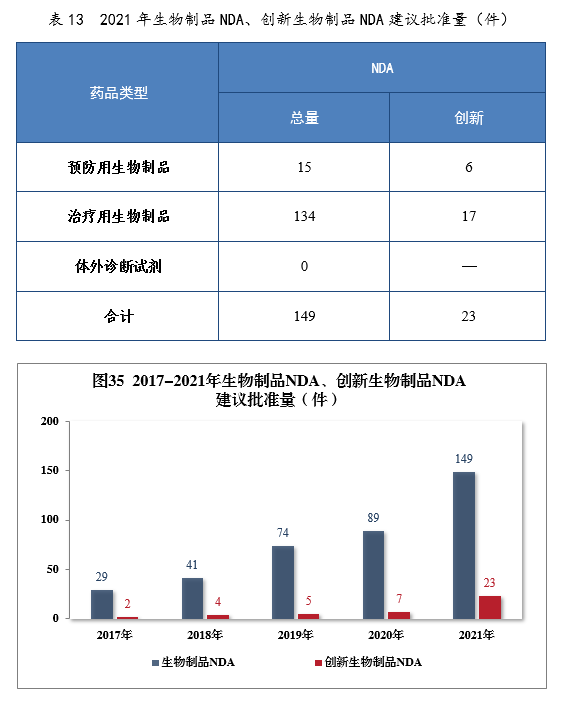
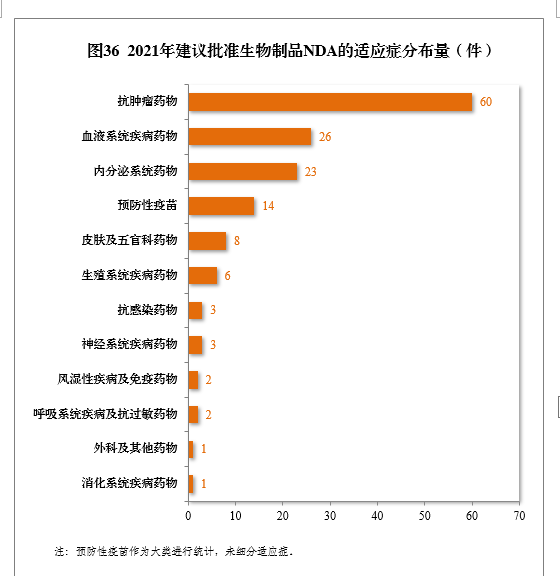
建议批准的生物制品NDA 149件中,抗肿瘤、血液系统、内分泌系统药物、疫苗较多,占全部生物制品NDA批准量的82.55%。2021年建议批准生物制品NDA的适应症分布量详见图36。
(六)行政审批注册申请审结情况
1.总体情况
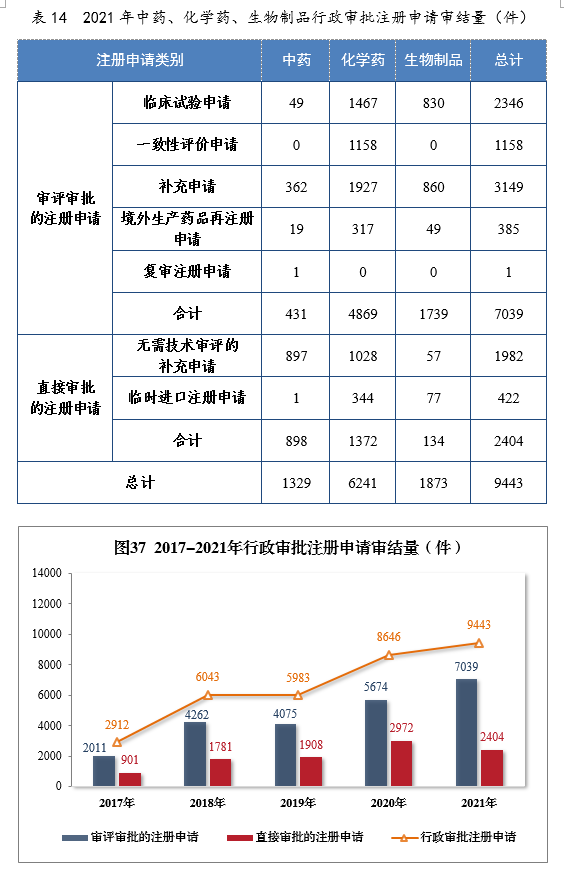
2021年审结行政审批注册申请9443件,同比增长9.22%。审评审批的注册申请217039件,同比增长24.06%;直接审批的注册申请222404件。2021年中药、化学药、生物制品行政审批注册申请审结量详见表14。2017-2021年需行政审批注册申请审结量详见图37。
2.审评审批的注册申请审结情况
审评审批的7039件注册申请中,以药品类型统计,中药注册申请431件,同比增长20.73%;化学药注册申请为4869件,同比增长19.16%,占全部审评审批审结量的69.17%;生物制品注册申请1739件,同比增长41.27%。以注册申请类别统计,临床试验申请2346件,同比增长39.15%;一致性评价申请1158件,同比增长85.87%;补充申请3149件,同比增长10.10%;境外生产药品再注册申请385件、复审注册申请1件。
3.直接审批的注册申请审结情况
直接审批的2404件注册申请中,以药品类型统计,中药注册申请898件、化学药注册申请1372件、生物制品注册申请134件。以注册申请类别统计,补充申请1982件、临时进口注册申请422件。
(七)药品注册核查情况
2021年合规审查8526件注册申请,以注册申请类别统计,NDA 617件,ANDA 2375件,一致性评价申请1687件,补充申请2423件,原料药注册申请1424件。
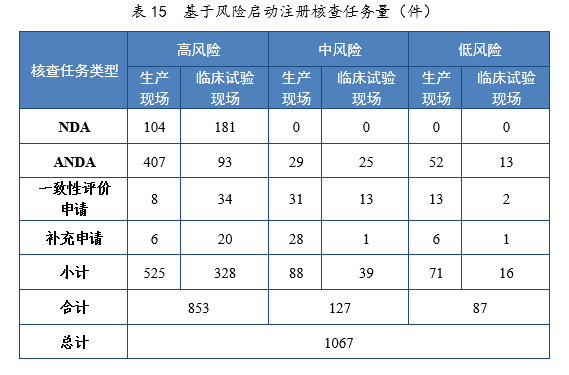
2021年基于风险共启动注册核查任务231067件,包括药品注册生产现场(以下简称生产现场)核查任务684件,药物临床试验现场(以下简称临床试验现场)核查任务383件;以注册申请类别统计,NDA核查任务285件,ANDA核查任务619件,一致性评价申请核查任务101件,补充申请核查任务62件。基于风险启动注册核查任务量详见表15。
此外,启动了新冠病毒治疗药物、新冠病毒疫苗的现场核查、有因检查34次。
2021年国家药品监督管理局食品药品审核查验中心共返回药审中心各类核查报告1165件。
第三章 药品加快上市注册程序和沟通交流情况
(一)药品加快上市注册程序情况
1.突破性治疗药物程序
2021年受理的注册申请中,申请适用突破性治疗药物程序的注册申请263件。经综合评估、公示,53件(41个品种)纳入突破性治疗药物程序,覆盖了新型冠状病毒感染引起的疾病、非小细胞肺癌、卵巢癌等适应症。2021年药审中心突破性治疗药物程序纳入情况详见附件6。2021年建议批准的NDA中,有5件被纳入了突破性治疗药物程序得以加快上市。
2.附条件批准程序
2021年建议批准的323件NDA中,共有60件(38个品种)经附条件批准后上市,占比18.58%。2021年新药上市许可的附条件批准情况详见附件1。
3.优先审评审批程序
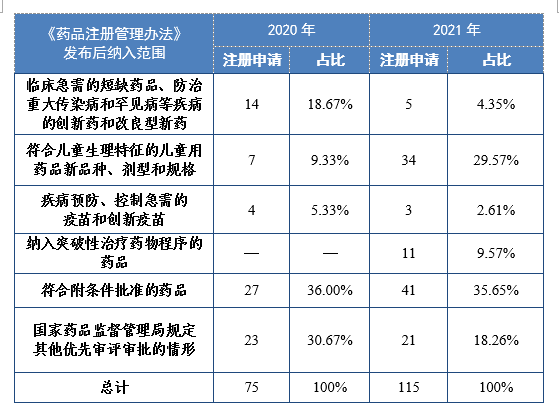
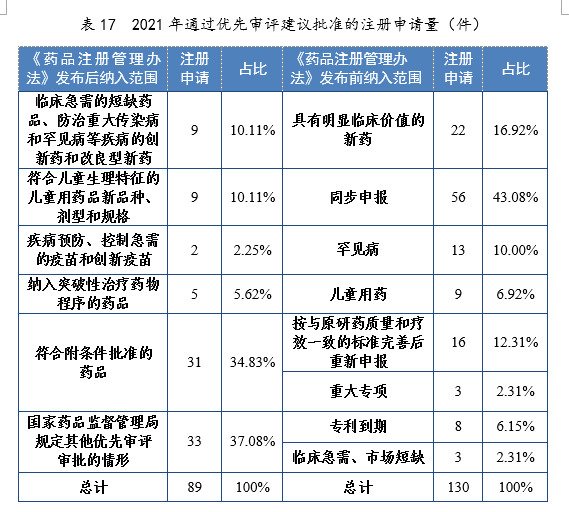
根据现行《药品注册管理办法》,2021年共115件注册申请(69个品种)纳入优先审评审批程序。其中,符合附条件批准的药品41件,占比35.65%,符合儿童生理特征的儿童用药品新品种、剂型和规格34件,占比29.57%。药审中心优先审评资源逐年加大向具有临床优势的新药、儿童用药、罕见病药物注册申请倾斜。
2020-2021年根据现行《药品注册管理办法》纳入优先审评审批程序的注册申请量详见表16。
表16 2020-2021年根据现行《药品注册管理办法》纳入优先审评审批程序的注册申请量(件)
4.特别审批程序
2021年审结81件纳入特别审批程序的注册申请(新冠病毒疫苗和治疗药物),其中,批准新冠病毒疫苗IND 12件,建议批准新冠病毒疫苗NDA 5件(均为附条件批准上市),分别为4件新型冠状病毒灭活疫苗(Vero细胞)、1件重组新型冠状病毒疫苗(5型腺病毒载体);批准新冠病毒治疗药物IND 15件,分别为小分子抗病毒药物4件,中和抗体9件,其他类药物2件;建议批准新冠病毒治疗药物NDA 5件,分别为清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒、新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198);批准涉及新冠病毒相关补充申请44件。
(二)与申请人沟通交流情况
药审中心不断调整沟通交流和咨询方式,以适应疫情防控常态化和申请人逐年增长的沟通交流需求。目前,药审中心与申请人沟通交流和咨询的方式主要有:召开沟通交流会议、药审中心网站(申请人之窗)一般性技术问题咨询、电话咨询、邮件咨询等。
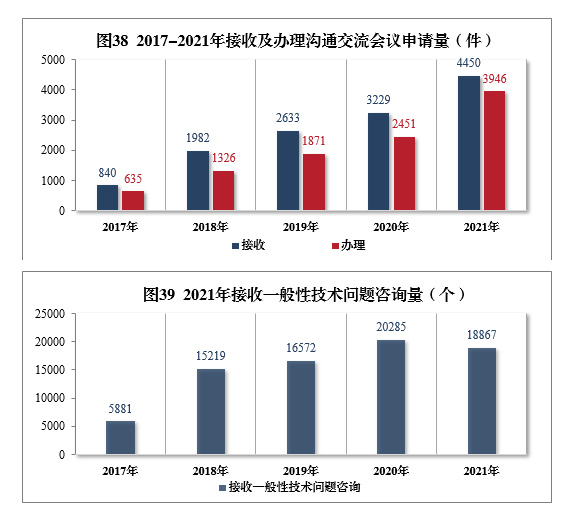
2021年接收沟通交流会议申请4450件,同比增长37.81%,办理沟通交流会议申请3946件,同比增长61.00%。接收一般性技术问题咨询18867个,办理一般性技术问题咨询18423个;办理电话咨询一万余次,8个联系邮箱24咨询近万次,2017-2021年接收及办理沟通交流会议申请量详见图38,2021年接收一般性技术问题咨询量详见图39。
2.沟通交流会议办理情况
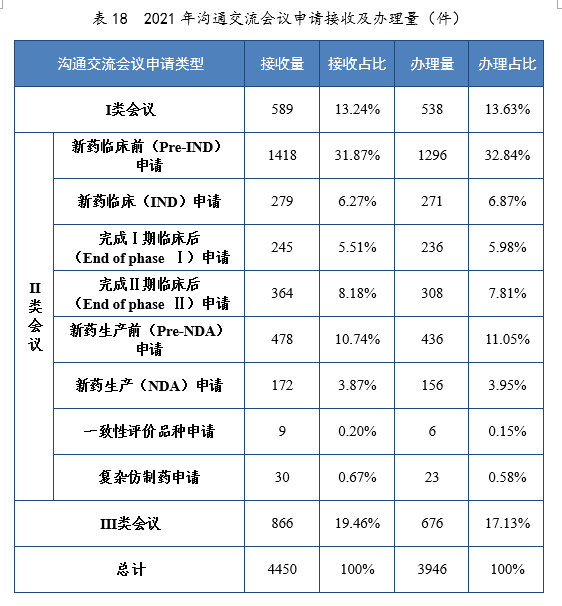
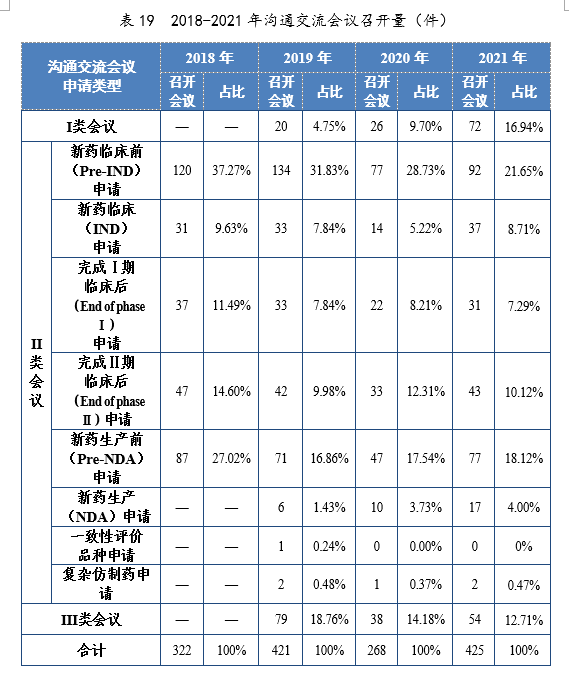
2021年接收沟通交流会议申请4450件。经综合评估,符合沟通交流会议召开条件的,及时与申请人取得联系,商议会议细节;无需召开沟通交流会议的,以书面形式尽快回复申请人。2021年办理沟通交流会议申请3946件,在药物研发关键阶段召开的Ⅱ类会议69.23%,其中新药临床前(Pre-IND)申请32.84%,新药生产前(Pre-NDA)申请11.05%。2021年沟通交流会议申请接收及办理量详见表18。
2021年召开沟通交流会议(面对面会议、视频会议和电话会议)425次,同比增长58.58%。Ⅱ类会议占比70.35%,其中新药临床前(Pre-IND)申请占比21.65%;新药生产前(Pre-IND)申请占比18.12%。2018-2021年沟通交流会议召开量详见表19。
第四章 药品注册申请存在的主要问题及分析
2021年,药品注册申请经技术审评后审评结论为不批准/建议不批准的注册申请542件,其中,359件属于因申请人未能在规定时限内补充资料的情形,占全年不批准/建议不批准总量的66.3%,包括中药9件、化学药349件、生物制品1件;183件注册申请主要存在申报资料无法证明申请注册药品的安全性、有效性或质量可控性等缺陷问题,包括中药14件、化学药126件、生物制品43件。
(一)主要问题
1.研发立题方面
这方面问题主要存在于早期开发品种(IND阶段)和某些仿制药及补充申请的开发立项阶段。具体包括:药物研发的临床定位不清,适应症选择不合理;剂型或给药途径选择不合理;已有研究数据提示药效作用不明显,作用靶点和机制不清晰,成药性风险高;联合用药违背临床诊疗和用药原则,或缺乏有效性和安全性研究数据支持;已有的研究数据不支持已上市品种的改良开发;仿制药研发的参比制剂因安全有效性问题已撤市;补充申请变更事项缺乏科学性和合理性。
2.有效性方面
这方面问题在上市注册申请中比较常见。具体包括:已有的临床研究数据尚无法证明品种的有效性;已开展的临床研究存在试验方案或者研究质量控制问题,无法评价受试品种的有效性;仿制药人体生物等效性试验结果表明和参比制剂不等效;化学药注册分类第3类的上市注册申请缺乏境内有效性临床数据。
3.安全性方面
药物安全性方面问题存在于药物开发的各个阶段。具体包括:早期(IND阶段)研究结果提示毒性明显或者安全窗过于狭窄,难以进入临床开发或提示应用于临床可能综合获益非常有限;临床前安全性研究方法或研究质量控制问题,或者研究数据不充分,不足以支持后续临床开发;已有的临床研究数据显示存在严重不良反应,临床应用获益和风险比值不合理;化学药注册分类第3类的上市注册申请缺乏境内安全性临床数据。
4.质量可控性方面
这方面问题常见于仿制药的开发。具体包括:药学研究存在严重缺陷,无法证明产品的质量可控性;申报资料无法证明仿制药与参比制剂质量的一致性;各开发阶段的研究受试样品不一致;样品稳定性研究结果、原料药起始物料选择等不符合仿制药上市技术要求;仿制药未按规定使用具有合法来源的原料药;样品复核检验不符合规定或检验方法存在严重缺陷。
5.合规性方面
这方面问题常见于经注册核查和注册检验的注册申请。具体包括:注册核查中发现研究数据存在真实性问题;注册核查中发现其他影响产品质量的重大缺陷;注册核查抽样检验不合格。
6.其他方面
具体包括:未按沟通交流时监管方提出的要求和标准提供研究数据或补充完善研究项目;审评中发现研究内容缺项,无法支持注册申请事项;药品说明书修订补充申请不符合说明书撰写要求和管理规范;用于支持变更补充申请的文献依据或者研究数据支持不足。
(二)与往年情况的比较
总体上看,2021年注册申请存在的主要问题,在分类、具体表现等方面与往年具有较大的相似性。但也出现了一些变化,主要包括:
1.出现的新问题
申请人未按在临床试验申请前沟通交流时监管方提出的补充资料要求提交研究资料,导致审评过程中发现IND研究内容缺项。根据现行《药品注册管理办法》第八十八条规定,申请人在药物临床试验申请的审评期间不得补充新的技术资料,致使审评不通过。
上述情况主要由于申请人未注意依据现行《药品注册管理办法》在审评期间不得补充新的技术资料,在提交注册申请资料时忽视了沟通交流中已明确的应提交的研究资料。此类情形是过往导致无法获批的原因中很少见到的。
2.基于某些问题而不批准的品种数量发生变化
一是2021年没有出现因未进行沟通交流而不批准的注册申请;二是因缺乏境内有效性、安全性临床数据而未获批准的化学药注册分类第3类上市注册申请数量较往年明显增加;三是因合规性问题而未获批准的注册申请数量较往年有减少趋势;四是开发立题合理性问题未获批准的注册申请数量增加趋势明显。
上述情况和注册申请过程中沟通交流管理要求,以及现行《药品注册管理办法》实施后化学药注册分类第3类上市注册申请审评结论管理要求的调整有关。
(三)启示和建议
对近期注册申请存在的主要问题进行梳理分析,可以从中得到启示,并为参与药物研发、注册、监管的各方提供参考建议。
1.充分重视药物开发立题依据
药物开发应立足于临床需求,尤其应重视解决未被满足的临床需求问题;应以临床价值为导向,充分重视同类创新药开发的优势问题,避免群体化、低水平、重复性创新;应充分评估改良型新药的临床价值和优势;变更补充申请应遵循必要性与合理性原则等。
2.利用好沟通交流机制
在已有的沟通交流机制下,申请人除了在药物开发过程的各关键节点提出沟通交流申请,还可以加强在研发其他环节和审评审批过程中的沟通交流;沟通交流应基于问题,解决问题,就关注的问题达成共识,消除信息不对等,不宜将沟通交流和行政审批程序等同起来;对于沟通交流达成的共识,各方应予以充分遵循。
3.加强创新药物开发的前期基础研究
某些新机制、新靶点宜做充分的成药性评估,开展尽可能多的概念验证研究,以降低后续开发风险,以免造成研究资源浪费;创新药商业开发策略应建立在科学性基础上,重视成药性证据链的完整性;应遵循药物开发的科学逻辑,循序渐进,尽量减少非科学因素对开发进程的干扰。
第五章 重点治疗领域品种
新冠病毒疫苗和新冠肺炎治疗药物:
1-2.新型冠状病毒灭活疫苗(Vero细胞)(北京科兴中维生物技术有限公司)、新型冠状病毒灭活疫苗(Vero细胞)(国药集团中国生物武汉生物制品研究所有限责任公司),适用于预防新型冠状病毒感染所致的疾病(COVID-19)。
3.重组新型冠状病毒疫苗(5型腺病毒载体),为首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
4-6.清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒,即“三方”品种,为《新型冠状病毒肺炎诊疗方案(试行第九版)》推荐药物,清肺排毒颗粒用于感受寒湿疫毒所致的疫病,化湿败毒颗粒用于湿毒侵肺所致的疫病,宣肺败毒颗粒用于湿毒郁肺所致的疫病。“三方”品种均来源于古代经典名方,是新冠肺炎疫情暴发以来,在武汉抗疫临床一线众多院士专家筛选出有效方药清肺排毒汤、化湿败毒方、宣肺败毒方的成果转化,也是《国家药监局关于发布〈中药注册分类及申报资料要求〉的通告》(2020年第68号)后首次按照“中药注册分类 3.2类 其他来源于古代经典名方的中药





