5月26日,传奇生物在其官微宣布,欧盟委员会(EC)已授予CARVYKTI(西达基奥仑赛,英文通用名Ciltacabtagene Autoleucel,简称Cilta-cel)附条件上市许可,用于治疗既往接受过至少三种治疗,包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体,并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。

传奇生物关联公司金斯瑞同日也发布了上述消息的公告。
西达基奥仑赛是传奇生物自主研发的靶向B细胞成熟抗原(BCMA)的定向嵌合抗原受体T细胞(CAR-T)疗法,该疗法含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,旨在增加其靶向癌细胞的综合能力,用于成人复发/难治性多发性骨髓瘤(MM)的治疗。
据悉,此次批准是基于关键性CARTITUDE-1研究结果,该研究纳入了既往接受过中位六线治疗(范围3-18)包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38抗体的患者。结果显示,在中位随访18个月(范围1.5-30.5)中,97例接受西达基奥仑赛一次性治疗的R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%(95%CI:92.7-99.7)。值得注意的是,80%的患者达到了严格意义的完全缓解(sCR),即治疗后无法通过影像学或其他检查观察到任何疾病体征或症状的措施。
在两项入组的179名成人患者的开放标签临床试验(MMY2001和MMY2003)中,评估了西达基奥仑赛的安全性,最常见的不良反应 (≥20%) 包括中性粒细胞减少症 、细胞因子释放综合征 、发热 、血小板减少症 、贫血 、白细胞减少症 、淋巴细胞减少症 、肌肉骨骼疼痛等。
今年2月28日,Cilta-cel的生物制品许可申请(BLA)已获得美国FDA批准,用于治疗复发/难治性多发性骨髓瘤(r/r MM)患者,成为首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批的靶向BCMA的CAR-T细胞疗法,目前其在美国定价为46.50万美元,约合人民币313万。
已上市CAR-T产品一览
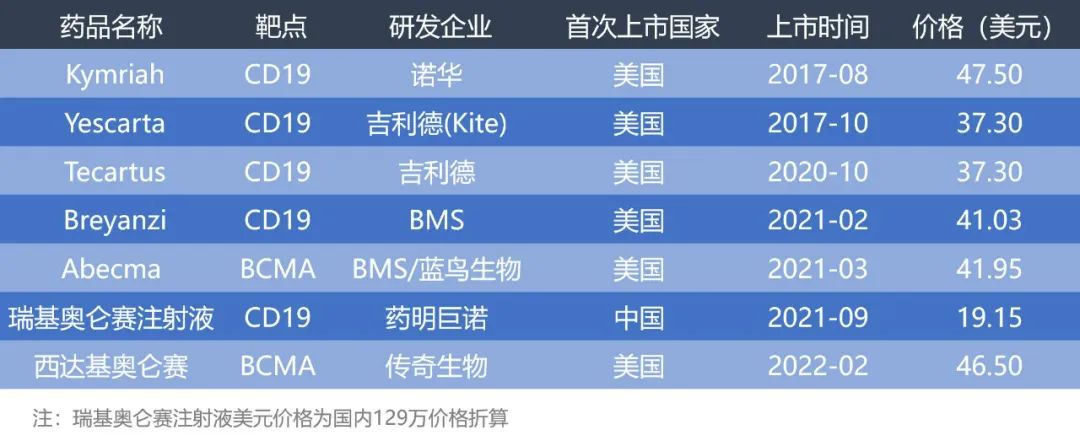
医谷制图
文 | 医谷
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..