4 月 6 日,百济神州宣布欧洲药品管理局(EMA)已受理 PD-1 单抗替雷利珠单抗(商品名:百泽安®)针对两大癌种的新药上市申请(MAA),分别用于食管鳞状细胞癌(ESCC)和非小细胞肺癌(NSCLC)。
值得一提的是,这是首款在欧洲提交上市申请的国产 PD-1 单抗,申报所依据的临床研究均为国际多中心 III 期临床,广泛纳入中、美、欧及其他国家的受试者。
本次申报上市的适应症包括:1)既往接受过全身化疗的晚期或转移性 ESCC;2)既往经化疗后局部晚期或转移性 NSCLC 单药治疗;3)联用卡铂和紫杉醇(或白蛋白结合型紫杉醇)一线治疗局部晚期或转移性鳞状 NSCLC;4)联用培美曲塞和含铂化疗方案一线治疗无 EGFR 或 ALK 阳性突变的局部晚期或转移性非鳞状 NSCLC。
据 Insight 统计,替雷利珠单抗在欧洲申报的 NSCLC 适应症一线及二/三线疗法均已在国内获批,而二线 ESCC 适应症当前在中国、欧洲、美国同时处于上市审评当中。3 月 31 日,Insight 数据库 监控到二线食管鳞癌适应症在华上市申请已经完成新报任务审评并离开新报任务队列,预计获批将近(点此一键跳转审评时光轴)。
「替雷利珠单抗」国内适应症申报详情
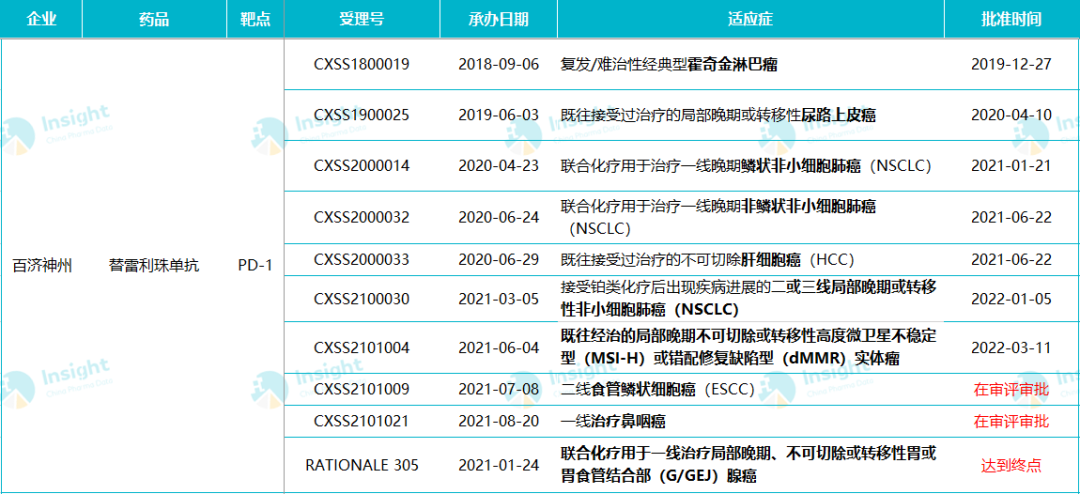
来源:百济神州官方资料,CDE 官网,Insight 统计
3 月份陆续的业绩公布之后,国内 PD-1 产品的 2021 成绩单已经逐渐出炉。百济神州的替雷利珠单抗 2021 年度国内销售额达 16 亿元,同比增长 56%;信达生物 PD-1 国内销售额也超过了 30 亿元。基于医保报销范围扩大带来的新增患者需求、进一步扩大的销售团队以及药品进院数量增加,这两家公司增长最为迅速。而君实生物的 2021 年度抗肿瘤收入为 4.12 亿元,这意味着特瑞普利单抗销售额同比锐减 58.96%;恒瑞医药尚未发布年报,但 2021 上半年卡瑞利珠单抗已经同比负增长。
在国内 PD-1/L1 赛道的白热化竞争当中,下一轮角逐已经转向全球市场。信达生物、君实生物、天晴康方、百济神州四家企业已经向 FDA 提交了新药上市申请(BLA)。信达的信迪利单抗一线治疗 NSCLC 的 BLA 申请在 3 月份遗憾收到 FDA CRL,未能获得批准;第二家君实则将在 4 月份获得 FDA 关于特瑞普利单抗用于鼻咽癌的审评决定,首家在海外上市的国产 PD-1 即将决出。
(关于国产 PD-1 美国申报详情,可查看 Insight 往期文章:信迪利单抗收 FDA CRL,国产 PD-1 出海临床数据盘点)
在肿瘤免疫疗法的海外市场拓展上,百济神州已经牵手诺华达成了多笔深度合作。在 2021 年 1 月 12 日,两家公司就替雷利珠单抗的海外开发、生产与商业化达成合作与授权协议,首付款高达 6.5 亿美元,总交易金额超过 22 亿美元,在当时同时创下两个国内最高纪录:首付金额最高、单品种授权交易金额最高。本次提交上市申请的欧洲正是诺华的合作授权地区之一。
同年 12 月 20 日又在 TIGIT 单抗 Ociperlimab 上再次合作,以 3 亿美元首付款获得了 ociperlimab 的选择权,如诺华行使选择权,将再向百济支付 6 亿或 7 亿美元的额外付款,加之潜在监管里程碑 7.45 亿美元、潜在销售里程碑 11.5 亿美元以及百分之二十到二十五左右不等的分级许可使用费,潜在交易金额超过 28 亿美元。
不光百济自研产品的出海交易,诺华也在 3 月下旬将 5 款已获批并纳入医保目录的抗肿瘤药的中国广阔市场营销、推广和销售权授予了百济神州。
此次百泽安®用于 NSCLC 的 MAA 递交是基于百济神州的 3 项临床试验(NCT03358875、NCT03594747、NCT03663205)的结果,这三项试验共纳入了 1499 例患者,其中包括一项 RATIONALE 303 试验。
RATIONALE 303 是一项随机、开放性、多中心的全球 3 期临床试验(NCT03358875),旨在评估百泽安®对比多西他赛用于治疗接受铂类化疗后出现疾病进展的二线或三线局部晚期或转移性 NSCLC 患者的有效性和安全性。该试验的主要终点为在全部患者(意向治疗患者人群)中以及在 PD-L1 高表达患者中的 OS;关键次要终点包括客观缓解率 (ORR)、缓解持续时间 (DoR)、无进展生存期 (PFS) 及安全性。
该试验由同济大学附属上海市肺科医院周彩存教授担任 Leading PI,共在美洲、欧洲、亚洲和大洋洲的 10 个国家入组了 805 例患者,以 2:1 的比例随机至百泽安®试验臂或多西他赛试验臂。4 月 13 日,在 2021 年 AACR 上,百济神州以口头报告的形式发布了 RATIONALE 303 研究的中期分析数据。
RATIONALE 303 研究结果显示,替雷利珠单抗治疗接受铂类化疗后出现疾病进展的二/三线局部晚期或转移性 NSCLC 患者的三个主要疗效指标都优于化疗。与多西他赛组相比,替雷利珠单抗组显著延长患者 OS,17.2 个月 vs. 11.9 个月,患者死亡风险显著下降 36%(下图);患者的 PFS 亦显著改善,4.1 个月 vs. 2.6 个月;ORR 较化疗提升 3 倍,21.9% vs. 7.1%。
RATIONALE 303 主要终点
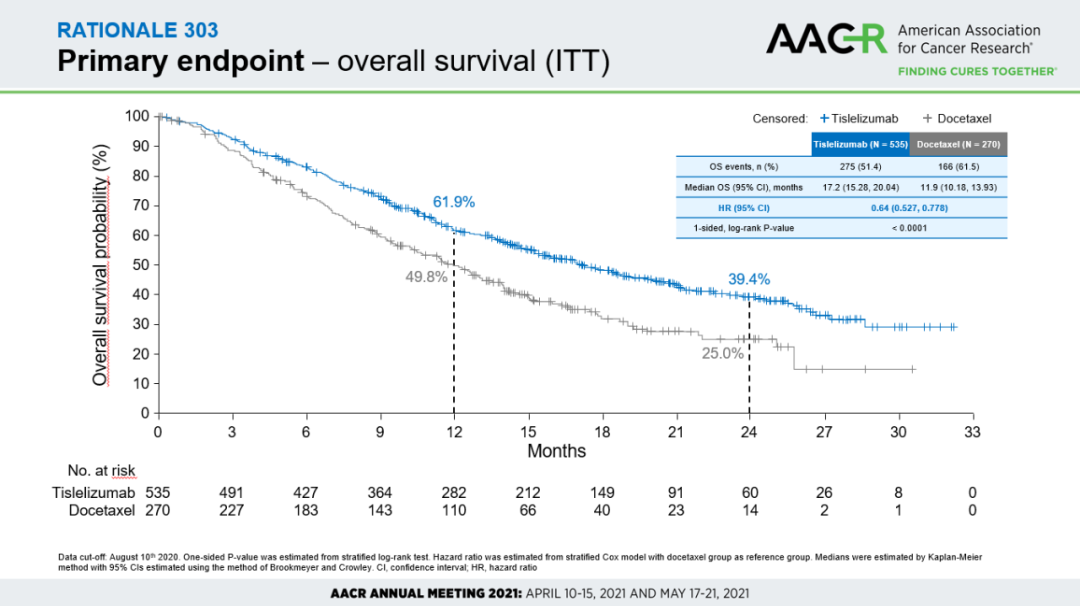
来自:2021AACR
并且,无论 PD-L1 表达阳性还是阴性,患者的 OS 均有获益。PD-L1≥1% 的患者,患者死亡风险下降 42%;即使是 PD-L1<1% 的患者,患者死亡风险亦可下降 26%。尽管很多化疗组的患者交叉接受了后线免疫治疗,但 RATIONALE 303 研究仍取得了确切的阳性结果,证明了替雷利珠单抗的突出疗效优势。
百泽安®用于 ESCC 的 MAA 递交则是基于百济神州 RATIONALE 302 临床试验的结果,这是一项随机、开放性、多中心的全球 3 期试验(NCT03430843),旨在评价百泽安®相比研究者选择的化疗方案用于晚期或转移性 ESCC 患者二线治疗的有效性和安全性。
该项临床试验的结果已在 2021 年美国临床肿瘤学会年会(ASCO 2021)上公布。递交资料中还包括在 7 项临床试验中 1972 例接受百泽安®单药治疗患者的安全性数据。
根据 2021 ASCO 会议公布的临床数据,该研究纳入 512 例患者(中位年龄:62,范围:36-86 岁),包括 404 例(79%)来自亚洲 10 个国家 132 个分中心,以及 108 例(21%)来自北美和欧洲。CDE 登记平台显示,该临床试验的中国实际入组人数为 300 例,因此前述 404 例亚洲患者中预计 100 余例来自亚洲其他国家,总体中国以外招募患者数约 40%。
试验结果显示,该研究的主要终点即意向性治疗(ITT)人群的中位总生存期(OS)达 8.6 个月,降低死亡风险超过 30%,且客观缓解率(ORR)达 20.3%,数据表现亮眼。百济此前新闻稿显示,RATIONALE 302 是首个食管鳞癌全球研究。
免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
编辑:加一
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..