已上市药品和治疗用生物制品的安全性监测是其整个生命周期的重要一环,在美国FDA,这是CDER下属的监测与流行病学办公室(OSE, Office ofSurveillance and Epidemiology)的主要工作。OSE下设有2个办公室共8个处。OSE有四个核心职能——药物警戒、药物流行病学、用药错误预防和分析、以及风险管理——并跨多个学科开展工作,以审查和评估药物的安全性。OSE使用各种工具和多学科在药品的整个生命周期中对药品的安全性进行监测和评估。


4月4日,OSE发布了2021年度报告(可登录识林查看详情报告),主要介绍OSE在识别、评估、预防、和监测药品风险方面的关键举措。报告突出强调了OSE通过审查和评估拟议和已批准的药品的安全性来改善公众健康的关键举措,重点是加强合作和建立新的伙伴关系以更好地分享药品安全信息。
2021年,OSE扩大了其使用的数据源组合,以改善对所有上市药物和治疗用生物制品的安全性相关问题的识别和监测,包括治疗COVID-19的紧急使用授权药物。这一举措使FDA能够更接近实时地识别安全性问题、不良事件和用药错误,使得FDA能够快速更新概括介绍(fact sheets)、标签和其他安全性沟通,以更好地保护公众健康。
此外,OSE发布了2个新的公共仪表板,改善了公众对药品安全型信息的访问:1)COVID-19公共仪表板,用于显示COVID相关疗法的不良事件报告的数据;2)REMS公共仪表板,用于有效报告生成(report-generating)能力、数据检索和风险评估和缓解策略(REMS)信息的分析。与此同时,在其他领域也采取了新的行动,如在新药办公室下设立专用药品安全小组,在哨兵系统倡议启动多个项目以更好的使用电子健康记录,以及重组用药错误预防和风险管理办公室(OMEPRM)等。
该报告从以下几个方面展开:OSE组织架构、COVID-19的应对、风险识别和评估、风险预防、风险管理、药品安全性现代化和创新、公众参与、展望(2022年及以后工作优先级)、附录-OSE发表的文章(58篇文章)。报告摘要如下:
应对COVID-19。OSE会对至少15个数据源的数据进行检查和分析,包括实时药物销售和处方数据,基于人口的数据源,FAERS报告,医学文献等。其中,2021年OSE工作人员浏览超过80,000份FAERS报告和66,000份已发表的COVID-19相关医学文献的摘要。
风险识别和评估。OSE有两个主要的上市后药品安全监测系统:一个是“被动”系统,称为FAERS;另一个是“主动”系统,称为哨兵哨系统。于2017年9月,OSE发布FARES公共仪表板,并于2021年3月发布COVID-19EUA FAERS 公共仪表板,每周定期更新。哨兵系统(FDA 电子安全性监测系统),是为了高效地分析大量电子医疗健康数据,以监控上市药品的安全性,帮助监管决策;还使用哨兵系统来提高人们对真实世界证据如何用于研究有效性的理解,还能用于处理公众健康危机,如COVID-19。2021年OSE在81个医疗产品的评估中使用了哨兵系统。
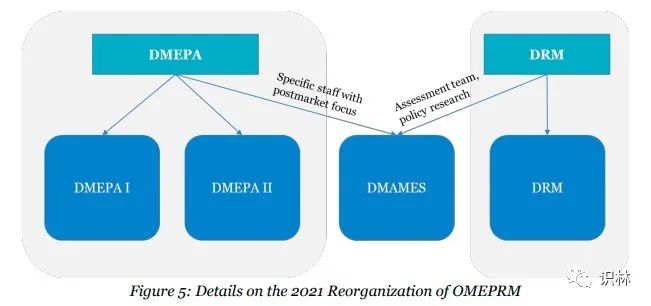
风险预防。用药错误预防和风险管理办公室(OMEPRM)主导CDER用药错误预防和分析计划,以及风险评估和缓解策略(REMS)计划。为支持用药安全性,2021年用药错误预防和风险管理办公室(OMEPRM)进行了重组。本次重组将用药错误预防和分析处(DMEPA)分为2个部门(DMEPA I和DMEPA II),专注上市前工作;成立新部门,缓解评估和用药错误监测处(DMAMES),重点关注上市后REMS评估和用药错误监测活动;并重组了风险管理处(DRM),重点放在上市前REMS和REMS修改审查活动上。
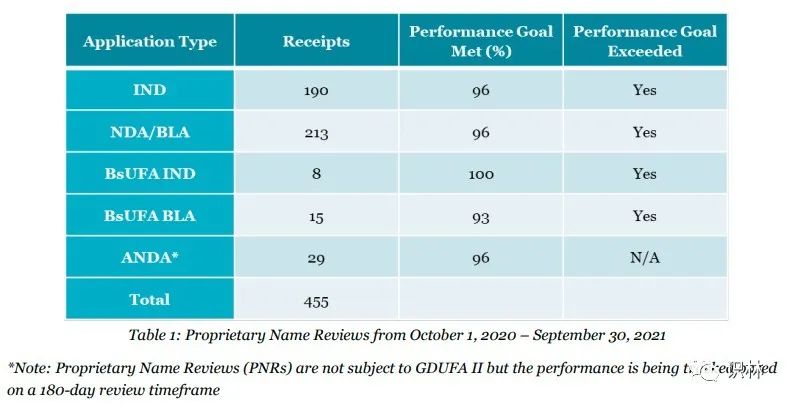
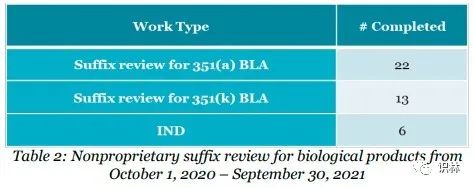
FY 2021,DMEPA I处和II处在规定时间内关于用户收费目标之专利名称审查的完成度超过93%,见(表1);同时,DMEPA审查了的41个生物药非专利名后缀(见表2)。
风险管理。OSE开发了用户友好的可视化的REMS公共仪表板,用于高效的报告生成能力、数据检索和可获得的REMS信息的分析,这使得医疗保健提供者、研究机构、学术界、工业界和其他联邦机构能够访问数据并生成报告。
药品安全性现代化和创新。上市后药品安全性领域不断发展,流行病学家和临床医生比以往任何时候都有更多的安全性数据来源和更丰富的数据集,新的方法和技术使我们能够更快地支持数据分析。以前做不到的,现在可以做到了,比如在观察性研究中分析怀孕患者或种族患者的不同影响。主要介绍了真实世界数据指南、药品安全性小组、人工智能的使用、运用先进分析的供应链监控,和计算机化标签评估工具(CLAT, Computerized Labeling AssessmentTool)。
《21世纪医药法案》要求FDA就真实世界证据(RWE)的潜在用途制定框架和指南,以帮助已获FDA批准的药物或生物制品的新适应症的获批,或帮助支持或满足这些产品的批准后研究要求。2021年9月,FDA发布指南:真实世界数据-评估电子健康记录和医疗索赔数据以支持药品和生物制品的监管决策,该指南为临床研究中使用的电子健康记录(HER)和医疗索赔数据的相关性和可靠性提供建议。
在2021年,FDA启动了三个新的药品安全性小组,每个小组监测一个上市药品组合的安全性。这些多学科专家团队监测并优先考量神经病学、肿瘤学和传染病等治疗领域中出现的一系列安全问题。
人工智能(AI)正在被开发作为决策支持工具的一部分,它可以有效地提取和组织信息,让专家有时间更专注于与公共卫生影响相关的复杂任务。人工智能正在应用于FAERS内的个例安全报告中包含的数据,以获得药物和不良事件之间的时间关系的可视化,支持重复报告的识别,并协助高信息质量报告的分类。
运用先进分析的供应链监控帮助评估某些关键药品短缺的风险,以便更早的识别和应对供应链中断,提高工作人员对药品的可及性和供需情况的预见性。
FDA授予了开发CLAT原型的合同,将使用现代人工智能方法来自动化手工标签审查工作,包括机器学习、自然语言处理和图像处理。自动化标签审查将提高运营效率,并有助于简化和标准化审查流程,以确保不同产品和审查团队之间的一致性。
公众参与。OSE举办多场公共研讨会,继续应对阿片类公共健康危机等。
2022年及以后工作优先级。OSE计划扩大风险管理、药物流行病学、用药错误预防和药物警戒能力,以支持PDUFA VII、GDUFA III和BsUFA III的重新授权和实施。
指南计划-定稿:FDA工作人员指南-药品和生物制品上市后安全性监测最佳实践。继续发展和扩大药品安全性小组的范围和职责,预计到2022年一季度末,小组数量达到9个。继续探索创新策略应对阿片类危机。哨兵系统进一步探索使用电子健康记录数据优化监测工作的方法,重点加强因果推断,以扩大使用真实世界数据来评估有效性。继续探索新的方法来评估不断增长的FAERS报告。改进评估措施和方法的开发,以评估REMS的有效性,并提高FDA审查评估报告的效率。
缩略词(部分)
FAERS:FDA AdverseEvent Reporting System,FDA不良事件报告系统;
REMS:RiskEvaluation and Mitigation Strategies,风险评估与缓解(或减轻)策略;
OSE:Office ofSurveillance and Epidemiology,监测和流行病学办公室;
OMEPRM:Office ofMedication Error Prevention and Risk Management,用药错误预防和风险管理办公室;
DMEPA:Division of Medication Error Prevention and Analysis,用药错误预防和分析处;
DMAMES:Division ofMitigation Assessment and Medication Error Surveillance,缓解评估和用药错误监测处;
DRM:Division ofRisk Management,风险管理处;
CLAT:ComputerizedLabeling Assessment Tool,计算机化标签评估工具
作者:识林-枍
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..