2 月 22 日,百济神州宣布,泽布替尼(百悦泽®)用于治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的新适应症上市许可申请(sNDA)已获美国 FDA 受理,PDUFA 目标日期为 2022 年 10 月 22 日。
同日,百济神州宣布欧洲 EMA 也已受理 BTK 抑制剂百悦泽®(泽布替尼)用于治疗慢性淋巴细胞白血病(CLL)患者和边缘区淋巴瘤(MZL)患者的两项新适应症的上市许可申请。
百济的泽布替尼 2019 年 11 月在美国首次获批,是首款获 FDA 批准上市的国产创新药;2021 年 11 月,泽布替尼在欧盟首次获批,用于华氏巨球蛋白血症(WM)成人患者。据 Insight 数据库 统计,目前泽布替尼已在全球 40 多个国家/地区获批上市。
泽布替尼全球适应症获批概况
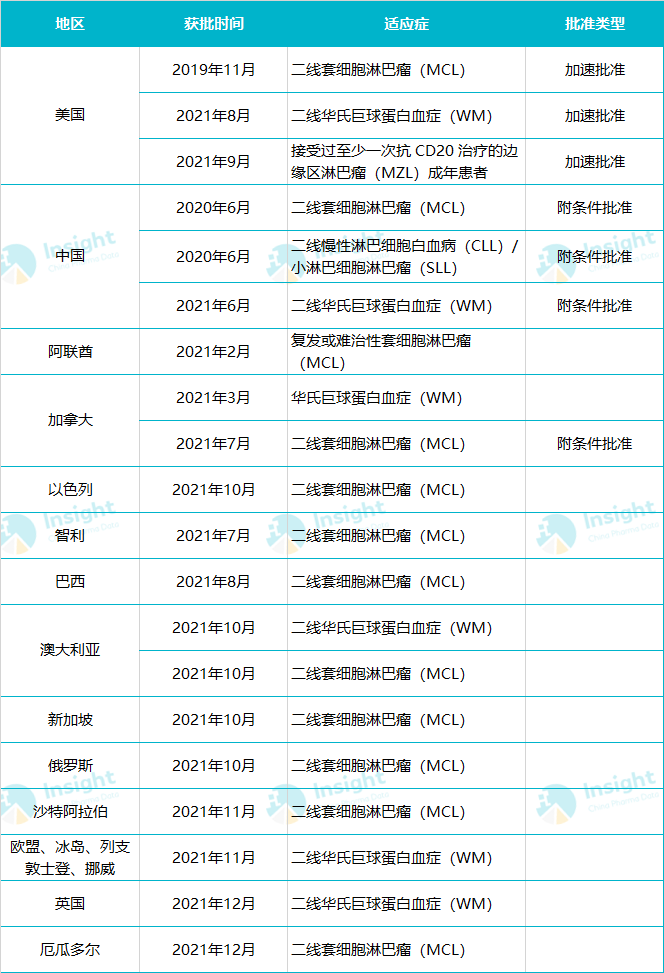
一线 CLL/SLL:中美欧同步申报上市
2022 年 1 月 28 日,百济神州宣布泽布替尼用于一线治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的适应症获 CDE 受理(受理号详情:CXHS2200007)。本次百济宣布在欧盟和美国提交上市申请,几乎与国内申报同步。
针对 CLL/SLL 的 sNDA 申报是基于 2 项关键性、随机的临床 3 期研究以及 8 项在 B 细胞恶性肿瘤中的支持性研究数据。其中百悦泽®治疗 CLL/SLL 的 2 项全球 3 期试验分别为:ALPINE 研究(NCT03734016),对百悦泽®与伊布替尼进行对比,用于治疗复发/难治性(R/R)患者;和 SEQUOIA(NCT03336333)研究,对百悦泽®与苯达莫司汀联合利妥昔单抗进行对比,用于治疗初治(TN)患者。
SEQUOIA 研究(NCT03336333)在初治性 CLL 患者中,对泽布替尼(百悦泽®)与苯达莫司汀联合利妥昔单抗(B + R)方案进行了对比。
结果显示,基于独立审查委员会(IRC)评估,百悦泽®在 PFS 方面展现了对比 B + R 方案的优效性。中位随访 26.15 个月时,百悦泽®组的 24 个月 PFS 为 85.5%(95% CI:80.1,89.6),B + R 组为 69.5%(95% CI:62.4,75.5),风险比(HR)为 0.42(95% CI:0.27,0.63),p < 0.0001。百悦泽®在患者中总体耐受性良好,安全性特征与其在广泛的临床项目中的表现一致,包括房颤的发生率较低。
此外,SEQUOIA 研究中的非随机组入组了伴有 17p 缺失的患者,旨在评估百悦泽®对这一高危人群的单药治疗效果。上述两项研究共入组了来自 17 个国家的患者,包括美国、中国、澳大利亚、新西兰和欧洲的多个国家。ALPINE 试验和 SEQUOIA 试验的结果分别在 2021 年 6 月的第 26 届欧洲血液学协会(EHA2021)线上年会和 2021 年 12 月的第 63 届美国血液学会(ASH)年会上报告。
MZL:美国已经获批,国内尚未申报
边缘区淋巴瘤(MZL)是一组始于淋巴组织边缘区的惰性非霍奇金淋巴瘤(NHL),约占西方国家所有 NHL 病例的 5 ~ 15%。在美国,这项适应症在 2021 年 9 月获得加速批准,而在中国,这项适应症尚未申报上市。
泽布替尼在欧盟用于 MZL 的新适应症上市申请是基于两项单臂临床试验的有效性结果:MAGNOLIA(NCT03846427),一项在既往接受至少一种含抗 CD20 抗体治疗方案的 R/R MZL 患者中进行的全球关键性 2 期试验,以及一项全球 1/2 期试验 BGB-3111-AU-003(NCT02343120)。这两项研究共入组了包括美国、中国、欧洲、澳大利亚和新西兰等 9 个国家的临床研究中心的患者。MAGNOLIA 试验的结果在 2020 年 12 月的第 62 届 ASH 年会上报告。
MAGNOLIA 研究(NCT03846427)是一项多中心、关键性 2 期临床试验,评估了泽布替尼在接受过至少 1 线抗 CD20 治疗的 R/R MZL 患者中的疗效。
研究共入组 66 例患者,其中 26 例为结外亚型,26 例为淋巴结亚型,12 例为脾亚型,4 例亚型未知。基于 CT 扫描的评估,ORR 为 56%(95% CI: 43, 68),完全缓解(CR)率达到 20%;基于优先 PET-CT 扫描的评估,ORR 为 67%(95% CI: 54, 78),CR 率为 26%。中位随访时间为 8.3 个月时,中位缓解持续时间(DoR)尚未达到,截至 12 个月时 85% 取得缓解的患者仍处于持续缓解中(95% CI: 67, 93)。所有 MZL 亚型患者中均观察到了缓解。
全球性 1/2 期临床 BGB-3111-AU-003 研究(NCT02343120)评估了 20 例 MZL 患者,包括 9 例结外亚型,5 例淋巴结亚型,6 例脾亚型。基于 CT 扫描的评估,泽布替尼取得的 ORR 为 80%(95% CI: 56, 94),CR 率为 20%。在中位随访时间 31.4 个月时,中位 DoR 尚未达到,截至 12 个月时,仍有 72% 取得缓解的患者处于持续缓解中(95% CI: 40, 88)。
两项临床试验在会议/期刊中公布的结果
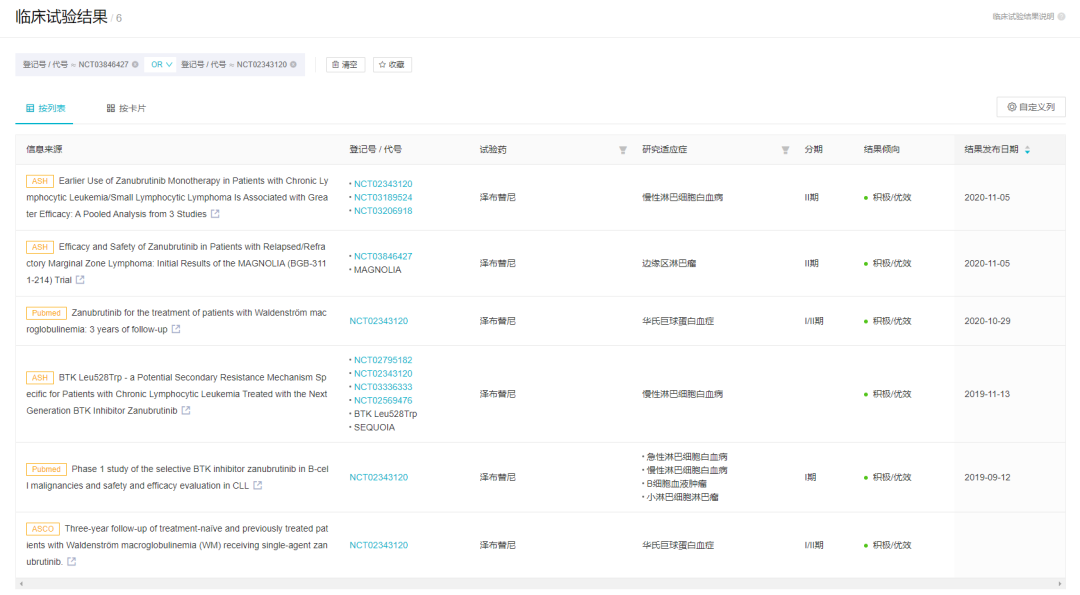
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..