事件:2月22日晚间,国家药品监督管理局药品审评中心(NMPA)发布关于《药审中心加快创新药上市申请审评工作程序(试行)》征求意见的通知(以下简称“征求意见通知”),面向社会各界征求意见和建议。

从今日市场反应看,A股和港股医药板块收盘涨幅超过5%的创新药企业中,部分几家近期处于舆论的风口浪尖,反弹幅度较大,但很难将上涨原因直接归到征求意见通知的出台上。
图1:2月23日A股医药板块涨幅5%以上的公司
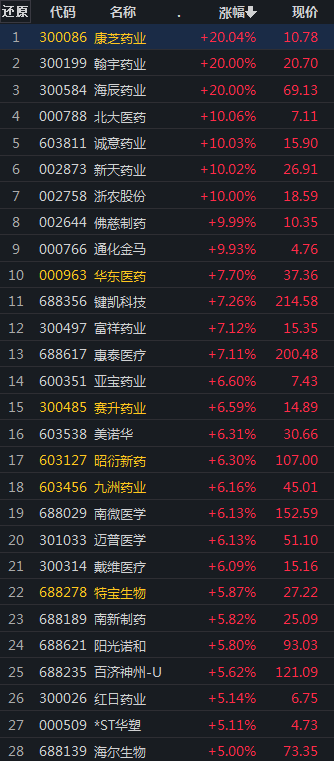
数据来源:iFinD
图2:2月23日港股医药板块涨幅5%以上的公司
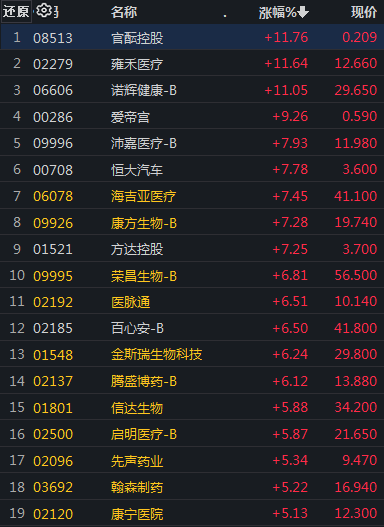
数据来源:iFinD
出现这一现象的部分原因可能是由于这份通知仅仅是整个程序的开端,从征求意见收集到征求意见稿出台还有一段时间,真正的提振效果可能延后显现。更多可能是当前国内创新药行业内卷过重、出海前景不乐观、估值过高的现状,导致投资者对整个创新药行业发展缺乏信心,对利好消息的反应也越发谨慎。
已经公布的征求意见的核心内容如下:
品种范围:适用于纳入突破性治疗药物程序的创新药
研发阶段:适用于申请人在探索性临床试验完成后,已具备开展关键性临床试验条件至批准上市前。本程序无需申请人申请,纳入突破性治疗药物程序的创新药品种可自动按照本程序开展后续沟通交流及审评审批工作。
工作程序:包括沟通交流、核查检验、受理及任务分配、专业审评、综合审评、审核签发和制件送局。其中,沟通交流是指企业按照《药物研发与技术审评沟通交流管理办法》中I类会议提出的沟通交流申请,具体包括关键性临床试验相关沟通交流、上市许可申请前(pre-NDA)沟通交流。
品种范围和研发阶段的范围可以看出,本次征求意见几乎是针对当前国内最富有竞争力的一类创新药物。而工作程序中,I类会议沟通交流环节的内容在2020年12月11日公布的《药物研发与技术审评沟通交流管理办法》中没有单独划出,在这次的征求意见中则得到了重点细化。
根据NMPA最新公布的《2020年度药品审评报告》显示,2020年药审中心收到147件突破性治疗药物申请,经综合评估、公示,已将24件突破性治疗药物申请(21个品种)纳入突破性治疗药物程序。
2021年,根据NMPA官网查询到的纳入突破性治疗药物申请名单数量增至52件,审评审批的速度显著加快,但相比突破性治疗药物所面临的临床紧迫需求来说,仍有非常大的提高空间。
表1:2021年NMPA批准纳入突破性治疗药物申请名单
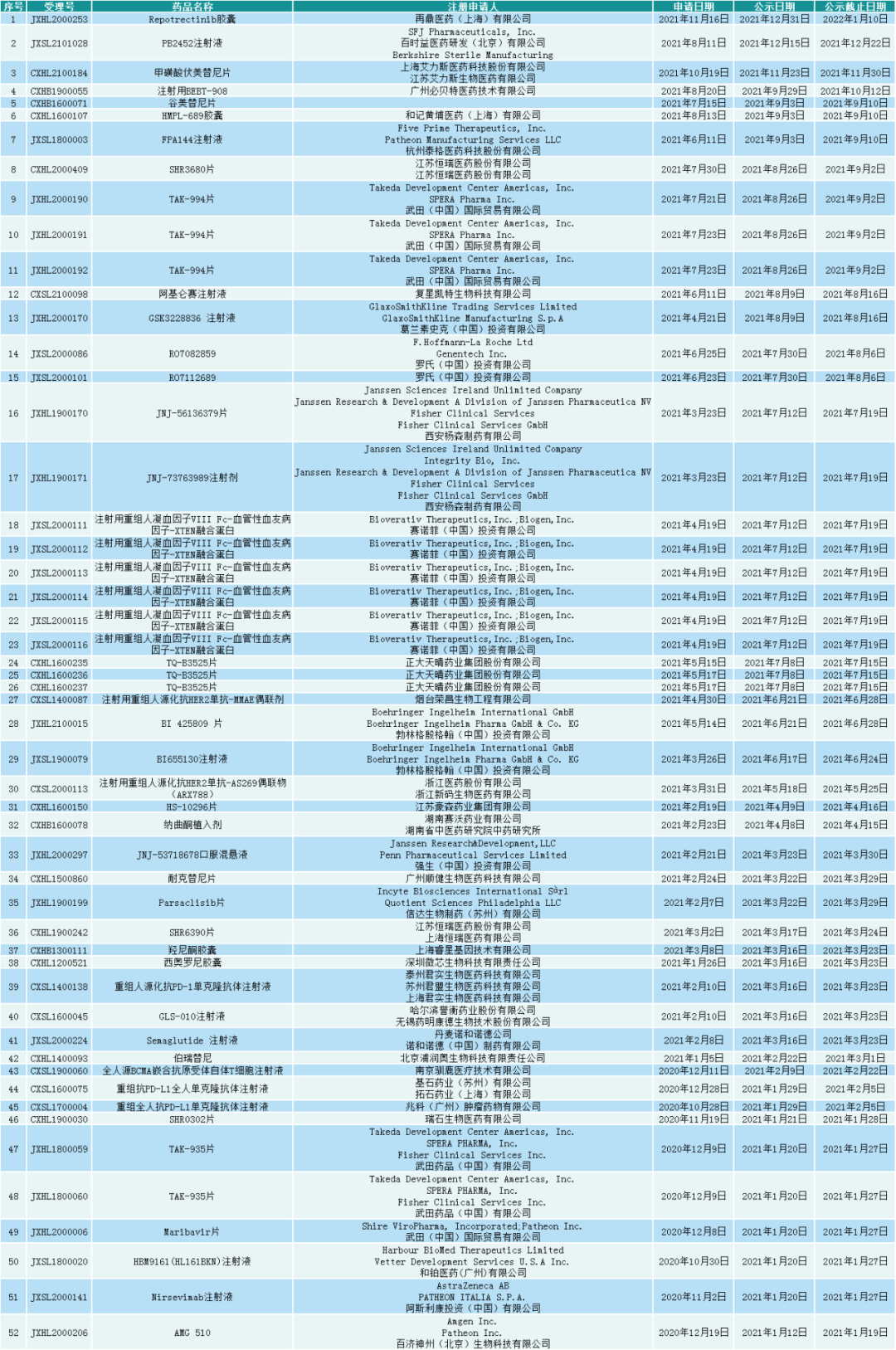
数据来源:NMPA,中康产业资本研究中心
本次征求意见旨在解决当前国内临床需求最紧迫、产品最富竞争力、最富发展前景的创新药物所面临的审评问题。在这批符合上市加速审评程序的企业中,有国内企业,也有国外企业。通过建立沟通交流程序,NMPA可以更好的推动国内创新药企业突破性产品加速上市,也可以充分了解国外创新药企业突破性产品在关键性临床试验和上市许可申请前的核心信息。
这次的征求意见也符合去年以来传达的回归以患者为中心的行业指导原则,同时再次体现了加速审评审批注册制度的宗旨要义。某种意义上说,这一程序优化可以视为是对前段时间FDA审评机构会议的回应,是为下一阶段国内创新药企业发展提供的政策辅助。
因此,本次征求意见通知是兼顾及时性和重要性的重要政策指导,未来征求意见稿正式出台后,将再次优化我国创新药行业审评审批制度,促进更多符合临床急迫需求、极富竞争潜力的创新药加速进入市场,为国内创新药企业国内市场拓展打开新的增长空间。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..