2021年6月1日,修改后的专利法正式施行,其中第七十六条规定,药品上市许可申请人与有关专利权人或者利害关系人就申请注册的药品相关的专利权纠纷,可以向国务院专利行政部门请求行政裁决。7月4日,经国务院同意,国家药品监督管理局、国家知识产权局制定印发《药品专利纠纷早期解决机制实施办法(试行)》(以下简称《办法》)。7月5日,国家知识产权局制定印发《药品专利纠纷早期解决机制行政裁决办法》。专利法的修订和上述办法的印发,为药品专利纠纷早期解决机制提供了法律和制度依据。
《办法》第六条规定,化学仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。声明分为四类:
一类声明:中国上市药品专利信息登记平台中没有被仿制药的相关专利信息;
二类声明:中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可;
三类声明:中国上市药品专利信息登记平台收录有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;
四类声明:中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
一类声明、二类声明和三类声明皆是仿制药企在没有有效相关专利的情况下上市,不存在专利挑战的问题,而四类声明,则往往伴随着专利无效及侵权诉讼的案件,是仿制药企与原研药企之间的博弈。四类声明目前主要分为4.1类挑战专利有效性和4.2类规避专利保护范围,前者指的是相关专利权应当被宣告无效;后者指的是仿制药未落入相关专利权保护范围。
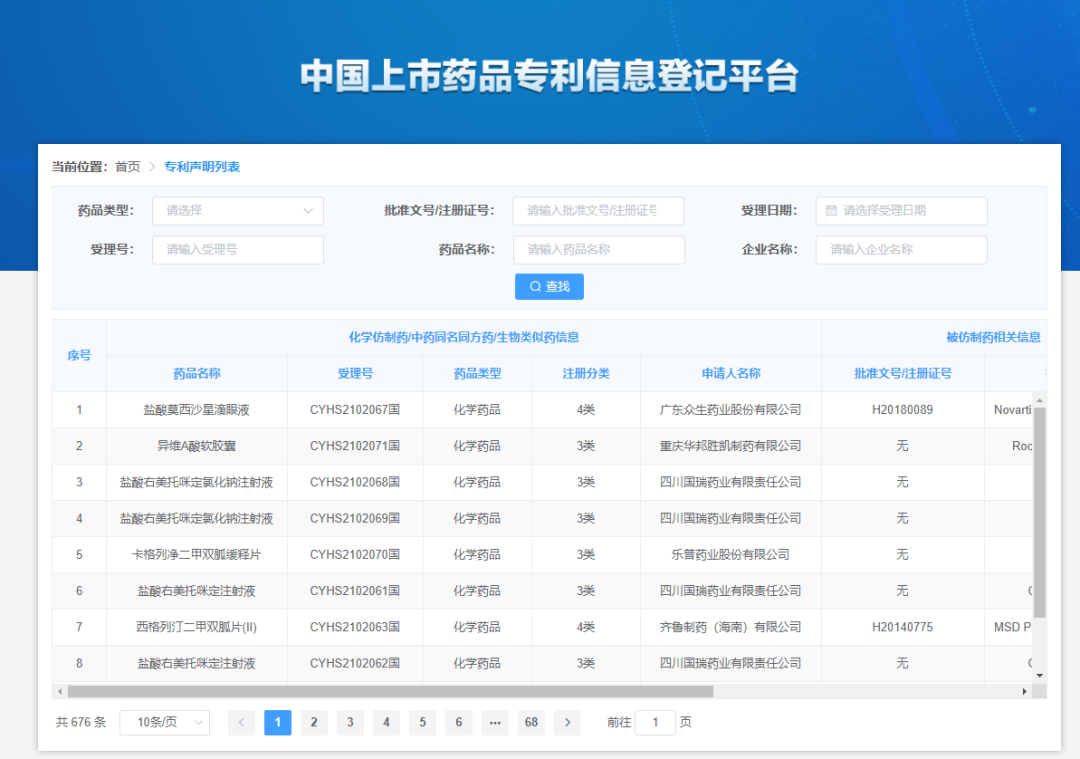
专利权人或者利害关系人对四类专利声明有异议的,可以自国家药品审评机构公开药品上市许可申请之日起45日内,就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。而超出45日,药监局将不会对化学仿制药注册申请设置9个月的等待期,一旦相关专利被攻克,原研药企将丧失专利链接保护新药的机会。
近日,我们梳理了中国上市药品专利信息登记平台中提出四类专利声明的药品信息,尤其4.1类声明的药品信息,见表1,共9种药品,针对原研专利提出的4.1类声明的国内药企包括:齐鲁制药、苏州特瑞药业、江苏豪森、南京正大天晴等。
表1 提出4.1类声明的药品
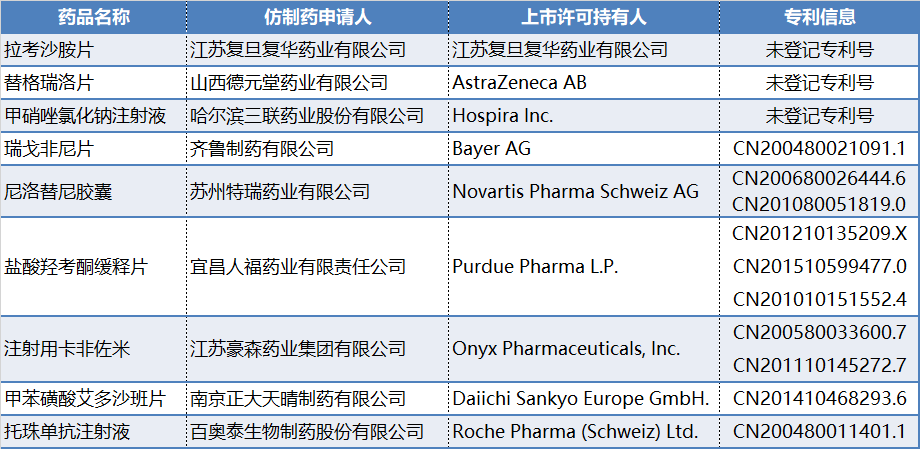
数据来源:医药魔方NextPat
其中,拉考沙胺片、替格瑞洛片和甲硝唑氯化钠注射液三个药品皆未登记专利号,不做进一步分析。
瑞戈非尼片:瑞戈非尼是一种新型口服多激酶抑制剂,是拜耳公司继索拉菲尼以后开发的新一代口服多靶点酪氨酸激酶抑制剂,2017年12月获批进入国内市场。CDE官网显示,4月19日扬子江仿制药瑞戈非尼片申报上市,为国内首家申报上市的仿制药,用于治疗结直肠癌、胃肠道间质瘤、肝癌。9月23日齐鲁制药瑞戈非尼片申报上市。
尼洛替尼胶囊:尼洛替尼是由诺华研发的一款二代BCR-ABL酪氨酸激酶抑制剂,2007年10月获得FDA批准上市,2009年7月获批进入国内市场。2021年9月15日,苏州特瑞药业仿制药尼洛替尼胶囊申报上市,为国内首家申报上市的仿制药。10月21日,齐鲁制药仿制药尼洛替尼胶囊申报上市。
盐酸羟考酮缓释片:1995年,盐酸羟考酮缓释片(奥施康定)上市,由Purdue Pharma研发,作为一种持久性麻醉剂,它可以帮患者缓解中重度疼痛,2004年,奥施康定在国内获批上市,由Mundipharma引进。2021年9月3日,合肥立方制药仿制药盐酸羟考酮缓释片申报上市,为国内首家申报上市的仿制药。2021年9月13日,宜昌人福药业仿制药盐酸羟考酮缓释片申报上市。
注射用卡非佐米:卡非佐米是一款蛋白酶体抑制剂,由Proteolix 开发,后被Onyx Pharmaceuticals收购,2013年安进斥资104亿美元收购Onyx Pharmaceuticals时获得该药,2021年7月,原研药注射用卡非佐米在国内获批上市。2021年9月7日,江苏豪森仿制药注射用卡非佐米申报上市,为国内首家申报上市的仿制药。
甲苯磺酸艾多沙班片:艾多沙班由Daiichi Sankyo开发的一款可直接作用于凝血因子Xa的新型抗凝药物,2018年12月原研药甲苯磺酸艾多沙班片在国内获批上市。2021年6月2日,海南先声药业仿制药甲苯磺酸艾多沙班片申报上市,为国内首家申报上市的仿制药。2021年8月25日,南京正大天晴仿制药甲苯磺酸艾多沙班片申报上市。
托珠单抗注射液:托珠单抗注射液由ChugaiPharmaceutical(Roche Pharma)研发,采用哺乳动物细胞(CHO)表达的抗人白介素6受体单克隆抗体制剂。2013年托珠单抗首次在中国获批,2021年11月8日,百奥泰仿制药托珠单抗注射液申报上市,为国内首家申报上市的仿制药。
根据新专利法的规定,上述药品皆在2021年6月1日前在国内申报上市,因此该药品相关专利到期时间按20年计算,如表2。由此可知,大部分专利在近三年内仍然有效,同时,专利类型涉及了化合物、盐、制剂、组合物和医药用途,为核心专利。
表2 被提4.1类挑战的药品相关专利信息
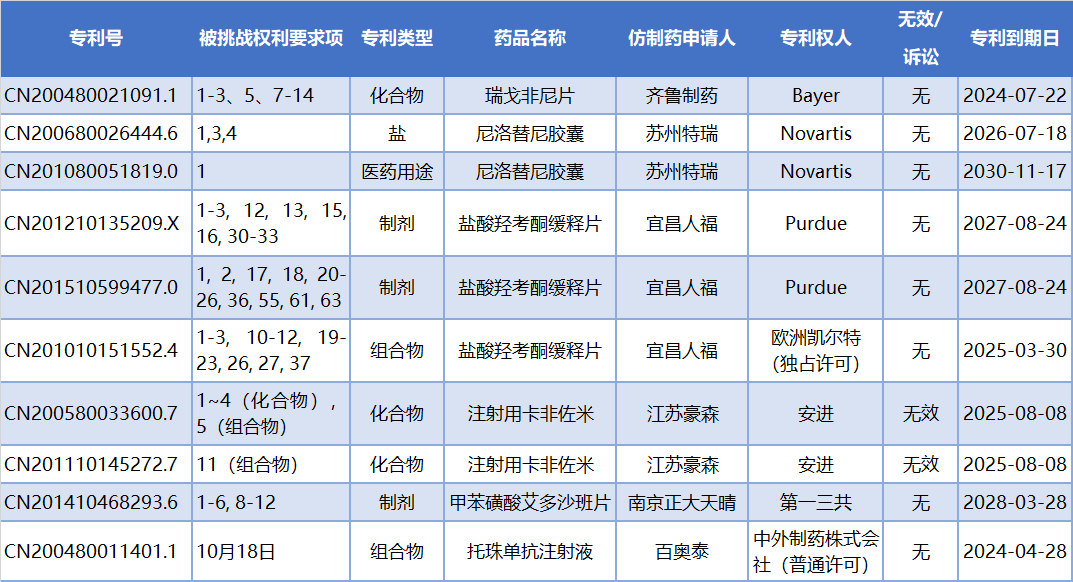
其中,江苏豪森已经针对卡非佐米的化合物专利发起无效请求,但经检索发现,江苏豪森对两件专利CN200580033600.7和CN201110145272.7提出的无效请求,专利局复审和无效审理部于2021年9月16日发文,皆维持专利权有效。
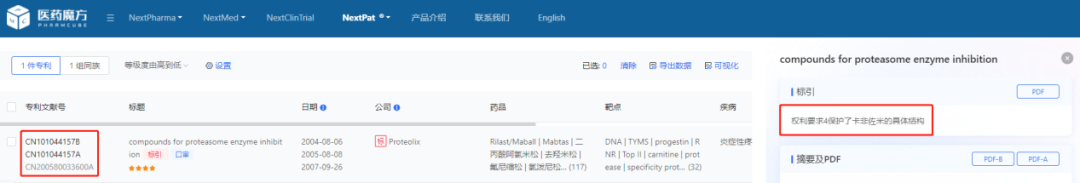
数据来源:医药魔方NextPat
中国上市药品专利信息登记平台正式运行已经数月,目前正面临4.1类专利挑战的药品共有9个,而已经向原研药企主动发动进攻的却只有江苏豪森一家,且以失败告终。那么,江苏豪森是会继续提起诉讼,还是就此放弃?其他药企是否已经准备好对原研药企专利提无效?究竟谁将是第一个获得国内12个月的市场独占期的企业?我们拭目以待!
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..