时间飞快,回首过去9个多月,FDA已经批准了多款潜在重磅药物,而且还有几款潜在重磅药物将在今年收到FDA回复。
据Fierce Pharma官网,未来三个多月,Argenx 的 efgartigimod、优时比的bimekizumab、罗氏/中外制药的Faricimab和辉瑞的abrocitinib四款潜在重磅药物有望获FDA批准。
1.efgartigimod
efgartigimod是一款靶向新生儿Fc受体(FcRn)的单克隆抗体。FcRn在全身都有广泛表达,在阻止IgG抗体的降解过程中起着核心作用。efgartigimod通过与FcRn结合,阻止IgG与FcRn结合,让更多的IgG被溶酶体降解,从而减少致病性IgG的水平,被开发用于治疗重症肌无力(MG)、寻常性天疱疮(PV)、免疫性血小板减少症(ITP)、慢性炎症性脱髓鞘性多发性神经病(CIDP)等由致病IgG抗体驱动导致的自身免疫性疾病。
2020年5月,efgartigimod治疗抗乙酰胆碱受体(AChR)抗体阳性全身性重症肌无力(gMG)患者的关键性3期临床试验ADAPT达到主要研究终点:与安慰剂组相比,efgartigimod治疗组有更高比例的患者为应答者(67.7% vs 29.7%;p<0.0001)。此外,efgartigimod治疗组有40%的患者实现了最小症状表达(Vs安慰剂组的11.1%)。
2021年,Argenx公司向FDA递交efgartigimod治疗gMG的BLA,成为首个递交BLA的的抗FcRn单抗,而其同靶点竞争对手优时比的rozanolixizumab、强生的nipocalimab、HanAll Biopharma/和铂医药的HBM9161等处于3期临床。业界预测efgartigimod 2026年销售额有望达到25亿美元
2.bimekizumab
bimekizumab是一款靶向IL-17A和IL-17F的新型人源化单克隆IgG1抗体。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。bimekizumab通过对IL-17A和IL-17F双重抑制发挥作用,被开发用于治疗斑块型银屑病、银屑病关节炎、中轴型脊柱关节炎和化脓性汗腺炎等多种炎症性疾病。
2020年9月,FDA和EMA同时受理了bimekizumab用于治疗中重度斑块型银屑病成人患者的监管申请。Evaluate 估计bimekizumab上市后2026年的全球销售额将达到20亿美元。
值得一提的是,在治疗中重度斑块型银屑病的3期研究中,bimekizumab疗效优于强生IL-12/IL-23抑制剂Stelara(ustekinumab,乌司奴单抗)、艾伯维的Humira(adalimumab,阿达木单抗)和诺华的IL-17A抑制剂Cosentyx(secukinumab,司库奇尤单抗)。
3. faricimab
faricimab是首个专门为眼睛设计的双特异性抗体,通过作用于血管生成素-2(Ang-2)和血管内皮生长因子A(VEGF-A)两个途径来治疗多种视网膜疾病。其治疗糖尿病黄斑水肿(DME)和新生血管性或“湿性”年龄相关性黄斑变性(nAMD)4项全球3期临床研究一致表明:与Eylea(aflibercept,阿柏西普)每2个月一次给药方案相比,faricimab每4个月一次给药方案在视力增益方面显示出非劣效性。
faricimab是第一种在治疗DME和nAMD的3期研究中达到4个月一次给药间隔期的注射用眼药,有望成为15年来第一种治疗nAMD和近10年来第一中治疗DME的新型药物,对阿柏西普、康柏西普以及雷珠单抗等VEGF/VEGFR抑制剂构成威胁,业界预估其2026年销售额有望达到11亿美元。
4.abrocitinib
abrocitinib是一种口服小分子JAK1抑制剂,目前其与皮下注射制剂Dupixent(dupilumab,度普利尤单抗,)治疗中度至重度特应性皮炎(AD)的头对头3期JADE DARE(B7451050)研究取得积极结果:与Dupixent相比,abrocitinib在每一个评估的疗效指标上都具有统计学上的优越性,且其安全性与先前的研究一致。
由于辉瑞JAK抑制剂Xeljanz导致患者接连出现安全事件,出于安全考虑,多款JAK抑制剂的上市申请被延期或拒批。abrocitinib也不例外,其治疗成人和青少年(≥12岁)中度至重度特应性皮炎(AD)的新药申请(NDA)被推迟,Evaluate估计到2026年其销售额可能达到10亿美元。
2021年FDA已经批准的潜在重磅药
除了上述即将获批的重磅药,据不完全统计,截至目前2021年FDA已批准了多款潜在重磅药,详见下表。
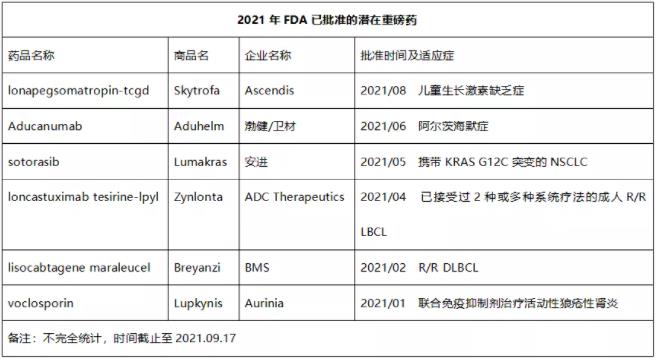
Skytrofa是全球唯一采用“瞬时连接(Transient Conjugation)”专利技术设计的人生长激素前药,每周给药一次。2021年8月,该药被FDA批准用于治疗儿童生长激素缺乏症(GHD),成为FDA批准的第一个治疗儿童GHD的长效生长激素疗法,Evaluate Vantage预测其2026年全球销售额有望达到15亿美元。值得一提的是,诺和诺德每周一次长效生长激素衍生物Sogroya(somapacitan-beco)也已被FDA批准用于成人治疗GHD。该药是一种人生长激素(hGH)的长效类似物,是天然的hGH经过修饰后增强了与血浆蛋白白蛋白的结合,达到每周1次给药的目的。目前,Sogroya正在开发用于治疗儿童GHD。
Aducanumab是渤健和卫材制药联合研发一款靶向β-淀粉样蛋白的重组嵌合人IgG1单抗,在争议声中于今年6月被FDA批准用于治疗早期阿尔茨海默病。Evaluate Pharma预测其2026年销售额有望达到49亿美元。
Lumakras是全球获批的首个KRAS靶向药,2021年5月被FDA批准用于治疗携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者,业界预测其2026 年销售额将接近20亿美元。
Zynlonta是全球批准的首款CD19靶向抗体偶联药物(ADC),2021年4月被FDA批准用于治疗已接受过2种或多种系统疗法的复发或难治性(r/r)大B细胞淋巴瘤(LBCL)成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)、起源于低级别淋巴瘤和高级别细胞淋巴瘤的DLBCL。业界预测其2026年销售额有望达到10.25亿美元。
Breyanzi最初由Juno研发,是一款CD19靶向CAR-T细胞疗法。与其他已经上市的CAR-T疗法,Breyanzi具有最好的安全性数据,其独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制(1:1),从而可以更好地控制细胞疗法的毒副作用。2021年2月,该药被FDA批准用于治疗在两种或两种以上全身治疗的复发或难治性的大B细胞淋巴瘤成人患者,成为FDA批准的第4款CAR-T细胞疗法。业界预测,2024 年Breyanzi全球销售额将达到 13.8 亿美元。
Lupkynis是一种钙调神经磷酸酶抑制剂,通过阻断IL-2蛋白炎症,稳定晚期狼疮肾炎患者可能受损的肾细胞。2021年1月,该药被FDA批准联合免疫抑制治疗方案治疗活动性狼疮肾炎的成年患者,成为继Benlysta之后FDA批准的第二种狼疮性肾炎治疗药物。于皮下或静脉注射的Benlysta相比,Lupkynis口服给药,患者依从性更好,业界预测其到2026年全球销售额或达10.63亿美元。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..