▎药明康德内容团队编辑
嵌合抗原受体(CAR)-T细胞疗法的诞生是人类与肿瘤的斗争中具有里程碑意义的事件。2017年,美国FDA首次批准了CAR-T细胞疗法,将该领域推入了一个快节奏的创新研究时代。今年初,来自麻省总医院(Massachusetts General Hospital)和哈佛医学院(Harvard Medical School)的研究人员在Nature Reviews Cancer上发表了一篇文献,回顾了过去三年来CAR-T细胞疗法在疗效和安全性方面的重大进展,讨论了有望在将来1–2年内进入临床的CAR-T细胞疗法新靶点和适应症,以及可能对CAR-T细胞疗法的未来发展有重大影响的新研究。
CAR的发展
第一代CAR由胞外抗原识别的单链抗体可变区片段(scFv)和胞内信号域(CD3ζ )组成,然而,这些CAR-T细胞由于扩增和持久性失败而在临床试验中几乎没有疗效。经过改造的第二代CAR引入了一个共刺激结构域,T细胞特异性表面糖蛋白CD28或肿瘤坏死因子受体超家族成员4-1BB。第二代CAR在抗肿瘤的同时完成自身扩增,延长体内存活时间。试验证明,第一批B细胞白血病患者接受第二代CD19靶向CAR-T细胞治疗后有显著和持久的反应,基于此,CAR-T细胞疗法彻底改变了血液系统恶性肿瘤的治疗。
文献指出,美国FDA批准的CAR-T细胞疗法来源于患者的自体细胞,可以避免同种异体排斥反应或移植物抗宿主病(GvHD),但需要按个体定制。截至2020年底,获FDA批准的CAR-T疗法均是以第二代CAR为基础所研发的。
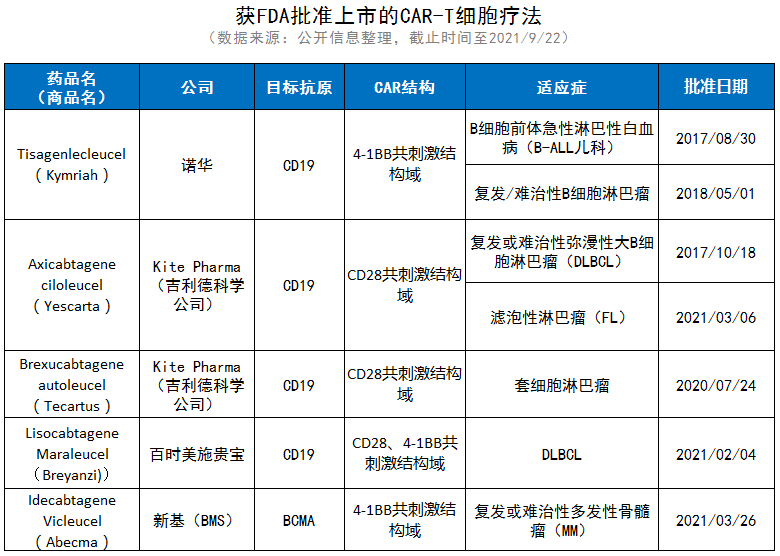
▲获FDA批准上市的CAR-T细胞疗法,统计截止时间至2021/9/22(参考资料[1]、FDA官网)
第三代“即用型”(off-the-shelf)CAR的不同之处是在一个构造中包含了两个共刺激结构域,使T细胞的杀伤力进一步得到增强(除了CD28和4-1BB之外,其他常见的共刺激域包括OX40、CD27和ICOS)。即用型异体CAR-T细胞疗法研发热度颇高,主要是为了提高产品标准化、缩短患者等待时间等。至于第四代CAR,则是一些研究者对具有增强T细胞功能的CAR的称呼。特别是当这些CAR产生额外的蛋白质分子(如细胞因子)或拥有额外的受体(如共刺激配体)时,它们也被称为TRUCKs或“装甲”CARs。
![]()

▲CAR-T细胞结构演变(图片来源:参考资料[2])
新靶点和适应症
多发性骨髓瘤
CAR-T细胞疗法治疗多发性骨髓瘤的主要靶点是B细胞成熟抗原(BCMA)。然而,正如CD19靶向CAR-T细胞治疗后出现CD19阴性复发,BCMA阴性复发可能发生。目前的替代选择是靶向BCMA和另一种在多发性骨髓瘤细胞上表达的分子——跨膜激活剂及钙调亲环素配体相互作用因子(TACI,也称为 TNFRSF13B)。
多发性骨髓瘤已确定的另一个靶点是G蛋白偶联受体GPRC5D,其在CD138阳性多发性骨髓瘤细胞上的表达与BCMA表达无关,也同样可以考虑用于CAR-T细胞的设计。
此外,多发性骨髓瘤的其他几个靶点也均在研发中,包括CD38、CD138和SLAM家族成员7(SLAMF7)。
实体瘤:“不限癌种”
CAR-T细胞疗法领域的一个主要关注点是其在血液恶性肿瘤之外的适用性。许多因素阻碍了在实体瘤中产生有效的CAR-T细胞,包括但不限于缺乏肿瘤特异性抗原和免疫抑制性肿瘤微环境(TME)。该领域的许多研究者认为,除了CD19之外,只有不到十几个可行的CAR-T细胞靶点,而识别在肿瘤中具有高、同质表达但在健康组织中没有表达的靶点已被证实并不容易。
在过去几年中,B7-H3(也称为CD276)免疫检查点分子一直是一种流行的免疫治疗靶标,一些有前景的临床试验用单克隆抗体靶向该分子。在高抗原密度的情况下,包括髓母细胞瘤、骨肉瘤和尤文肉瘤在内的几种儿科癌症,B7-H3靶向CAR-T细胞在体外和体内均有效的。然而,当抗原密度较低时,B7-H3靶向CAR-T细胞的活性要低得多,这表明在临床中可能存在一个有效的、无毒的B7-H3靶向CAR-T细胞治疗窗口。
近年来,针对间皮素的CAR-T细胞已被用于各种适应症,包括胰腺癌、肺癌和卵巢癌。目前正在进行一些临床试验,初步结果表明,间皮素靶向的CAR-T细胞是安全的,并有抗肿瘤活性的证据,这说明CAR-T细胞治疗实体肿瘤的未来是有希望的。其他临床研究正在评估中间皮素靶向CAR-T细胞治疗是否可以通过联合免疫检查点抑制剂来增强T细胞反应。
实体瘤:脑癌
脑肿瘤对免疫疗法的反应相对较小。然而,由于脑的独特微环境,CAR-T细胞疗法有治疗脑肿瘤的潜力。与大分子因血脑屏障而难以进入脑肿瘤不同,T细胞和T细胞疗法在静脉输注后可浸润大脑。针对胶质母细胞瘤的CAR-T细胞疗法的初步临床试验靶向EGFRvIII、IL-13受体α2(IL-13Rα2)和人表皮生长因子受体-2(HER2),但由于靶抗原丢失,疗效甚微。为了克服胶质母细胞瘤中经常发现的靶抗原表达的异质性,一种基于氯毒素(CLTX)肽的CAR-T细胞被设计了出来,该肽即使在不存在其他胶质母细胞瘤相关抗原的情况下也具有强效抗肿瘤活性。
以神经母细胞瘤为靶点的双唾液酸神经节苷脂GD2靶向CAR-T细胞之前在临床试验中显示出良好的耐受性。研究还表明GD2靶向CAR-T细胞可能对组蛋白H3 K27M(H3-K27M)突变的弥漫性中线胶质瘤有效,这是一种普遍致命的儿童癌症。
此外,细胞表面硫酸乙酰肝素蛋白多糖GPC2也被选为神经母细胞瘤的新靶点。GPC2在神经母细胞瘤组织上高表达,而在正常小儿组织上不表达,被证明是一种有效的CAR-T细胞靶点。
结语
CAR-T细胞疗法已经迅速在临床中发展,越来越多的临床前和临床试验结果揭示了新的疗效、耐药性机制等,并推进了对新靶点的寻找、信号机制的阐明和新技术的应用。CAR设计、转导方法和最佳细胞类型选择方面的创新,必然会改善疗效,并为许多不同类型的癌症患者提供全新的治疗选择。
参考资料:
[1]Recent advances and discoveries on the mechanisms and functions of CAR T cells. Retrieved 2021-09-22, from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8353572/
[2]Zhonghua Xue Ye Xue Za Zhi. Structural evolution and prospect of chimeric antigen receptor T cell (CAR-T cell). Chinese Journal of Hematology. 2020 Nov; 41(11): 964–968
四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..