近日,FDA对Jak抑制剂引起严重心脏相关事件、癌症、血栓和死亡风险增加发出警告,预计会导致该类药物在某种程度上使用的减少,但此次监管行动的力度无疑超出业界预期。
该监管机构得出的结论是:托法替布(Xeljanz和Xeljanz XR)严重心脏事件风险的增加是一种类效应(Class Effect),并将这类药物在类风湿性关节炎中的使用限制在对TNF阻滞剂治疗失败的患者中。
事件回顾
9月1日,根据美国食品药品管理局(FDA)对一项大型随机安全临床试验的完整审查,该机构得出结论:关节炎和溃疡性结肠炎药物Xeljanz和Xeljanz XR(托法替布)心脏病发作或卒中等严重心脏相关事件、癌症、血栓和死亡风险增加。
该试验将Xeljanz与另一种用于治疗类风湿性关节炎患者的关节炎药物肿瘤坏死因子(TNF)阻滞剂进行了比较。该试验的最终结果还显示,较低剂量的Xeljanz会增加血栓和死亡的风险。该试验早期结果报告称,Xeljanz仅在较高剂量下才会出现血栓和死亡风险增加。
FDA要求对与Xeljanz属于同一药物类别(Jak抑制剂)的另外两种关节炎药物:礼来的Olumiant(巴瑞替尼)和艾伯维的Rinvoq(乌帕替尼)发布新的和更新的安全性警告。
Olumiant和Rinvoq尚未进行类似于Xeljanz的大型安全性临床试验的研究,因此尚未充分评估其风险。然而,由于这两种药物与Xeljanz具有相同的作用机制,因此FDA认为这些药物可能具有与Xeljanz安全性试验中所见相似的风险。
另外两种Jak抑制剂:Incyte公司的Jakafi(鲁索替尼)和百时美施贵宝的Inrebic(fedratinib)不适用于治疗关节炎和其他炎症,因此不属于Xeljanz、Xeljanz XR、Olumiant和Rinvoq处方信息所需更新的一部分。Jakafi和Inrebic用于治疗血液疾病,需要对其处方信息进行不同的更新。
潜在输家
FDA的裁决可能决定了Jak抑制剂类药物未来的临床应用地位,但监管机构明确的安全警告排除了Jak抑制剂未来进入更早治疗线的可能性。该事件还将会巩固抗TNF药物在类风湿性关节炎中的主导地位。
令人担忧的是,在针对Jak抑制剂更加严格的使用条件或批准次优剂量方面,FDA不会止步于类风湿性关节炎适应症。Jak抑制剂类药物目前正在排队争取在其他炎症性疾病(如银屑病关节炎和特应性皮炎)以及其他被认为不会限制的疾病(如脱发)中获得批准,也不排除这些申请有被拒绝的风险。
不过,据全球知名医药市场调研机构Evaluate Pharma称,Jak抑制剂预计至少在2026年之前仍将是类风湿性关节炎领域最畅销的药物类别之一。然而,由于对FDA下一步行动的担忧,FDA宣布消息的当天,艾伯维的市值蒸发了150亿美元,同时市场也在寻找潜在的受益者。
艾伯维在FDA的强硬立场中成为损失最大的公司。Rinvoq是该公司最大的销售增长动力,此前预计到2026年,该药物的年销售额将激增至90亿美元。类风湿性关节炎适应症预计将占其销售额的一半左右,尽管FDA的行动仅适用于美国,但美国家预计是Rinvoq利润最高的地区,且占总销售额的三分之二。此外,Rinvoq在特应性皮炎、银屑病关节炎和强直性脊柱炎方面的上市申请屡遭FDA延迟审查。
辉瑞是另一个潜在的大输家:该公司已将其新的Jak抑制剂abrocitinib的开发重点放在特应性皮炎上,而FDA的决定自4月以来被推迟。
礼来的Olumiant用于重度特应性皮炎患者适应症的上市申请也被FDA延迟审查2次。〖四大Jak抑制剂:遭FDA延迟审查后将迎最终决定?〗
根据Evaluate Pharma此前预测的数据,到2026年,Jak抑制剂类别的售额将会接近150亿美元,现在看来这些数字不太可能成为现实。〖类风湿关节炎:生物药热潮渐退,JAK机会来了〗
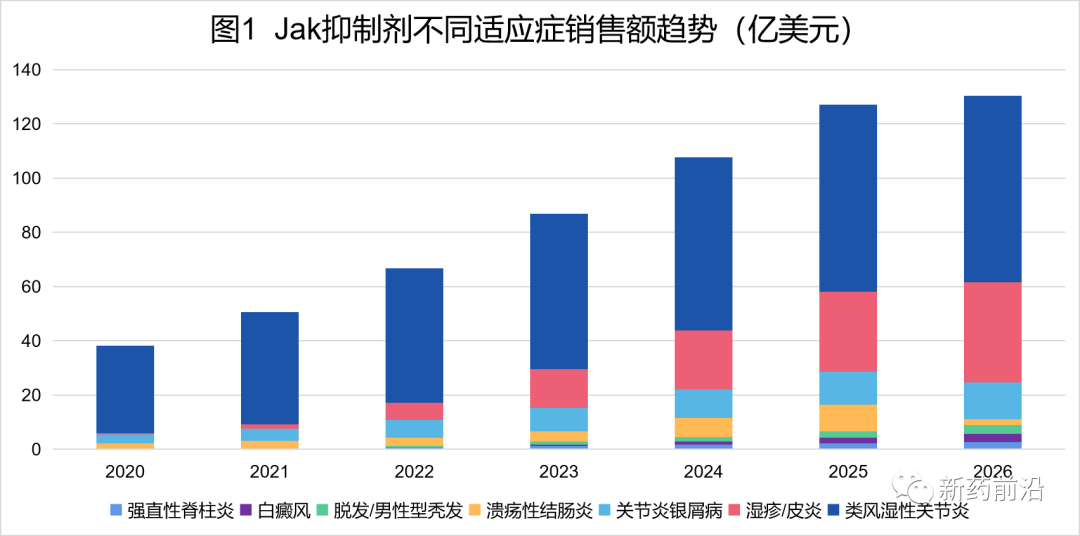
潜在赢家
多年来,FDA似乎对开发者试图利用Jak抑制剂之间的差异不屑一顾。例如,艾伯维长期以来一直认为Rinvoq对Jak1的选择性使其比同时靶向于Jak2和3激酶的分子更安全。〖专题|JAK抑制剂•机制篇:各显神通,抢占不同位点〗
Tyk2抑制剂的开发者也在紧张地转移监管机构对Jak抑制剂安全性的担忧。不过,作为同一家族,Tyk2被怀疑论者称为“第四个Jak”,并且仅在名称上有所不同,而不是激酶功能上。目前百时美施贵宝和辉瑞是Tyk2的大玩家。〖诺诚健华加入TYK2竞赛,全球最快已进Ⅲ期〗
因此,艾伯维面临的困境是其是否应该尝试通过进行Rinvoq大型心血管结局研究来反驳监管机构的类效应说法。鉴于此举可能适得其反,且似乎不太值得冒险。该公司可能会考虑重新关注其第二个主要增长动力Skyrizi(risankizumab),可能是一个更好的选择。〖“药王”Humira即将专利到期,艾伯维拿什么补缺〗
Skyrizi是一种抗IL-23抗体,这一类药物已被证明对银屑病非常有效,在炎症性肠病中也有很大的潜力。事实上,IL-23这种机制可能成为Jak安全事件的受益者之一。其他IL-23参与者包括强生已获批上市的Tremfya(古塞奇尤单)和礼来在研发的mirikizumab。〖强生新一代银屑病药物Tremfya:立足未满足临床需求,终成利基市场霸主!〗
假设FDA也推迟Jak抑制剂在特应性皮炎中的使用,赛诺菲和再生元Dupixent(度普利尤单抗)的竞争威胁也将减弱。〖特应性皮炎领域潜藏重磅药浮现〗
同时,抗TNF药物的制造商可以继续占据市场;该领域的主导产品当然是艾伯维的Humira(阿达木单抗)。该药物已经在很长一段时间内推迟了生物类似药在美国上市,其中Humira生物类似药要到2023年才能在美国上市。而安进的Enbrel(依那西普)的生物类似药可能要到2030年才能进入市场。
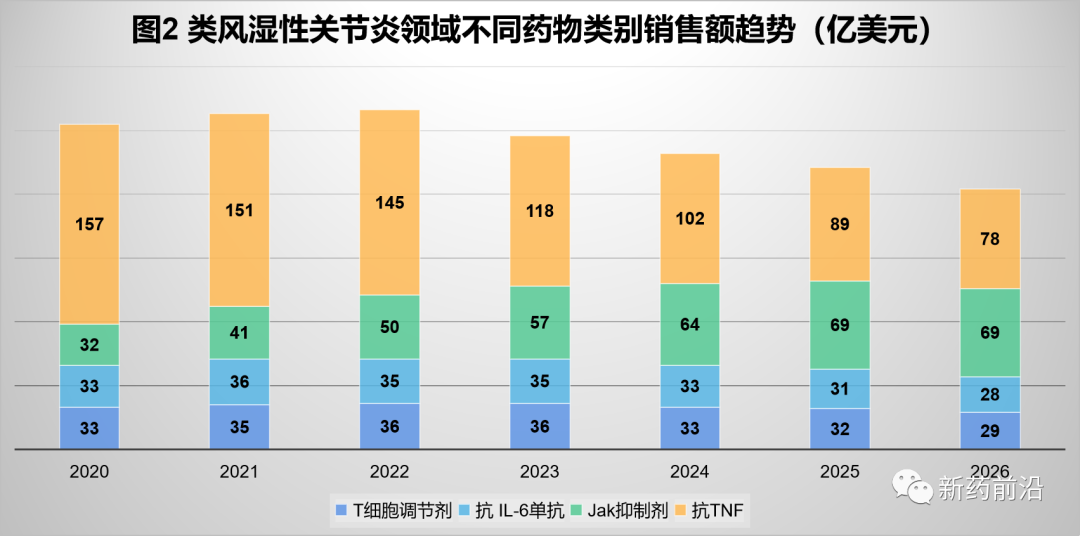
新机制的开发者也可能从强大竞争对手的削弱中受益。其中包括Aclaris公司的MK2抑制剂,已在类风湿性关节炎中取得早期成功,Arena则希望其S1P调节剂etrasimod在未来几个月内对各种炎症性肠病产生积极结果。
安全性门槛在提高?
生物制药业界观察家还将考虑FDA针对Jak抑制剂采取行动的更广泛影响。Leerink分析师将这一行动描述为“非同寻常”,并表示考虑到可用数据以及抗TNF所带来的不可忽视的风险,该机构的立场很难证明是合理的。他们思考“这是否相当于继续将FDA的决策政治化”。
无论是否政治化,近期的另一个例子恰说明欧洲和美国监管机构在风险与收益之间的鸿沟不断扩大。最近在对珐博进的罗沙司他审查中也看到了这一点,该药物已获得欧洲药监局(EMA)批准,但仍因心脏安全问题而在FDA中停滞不前。与此同时,EMA没有显示出限制Jak使用的迹象。
FDA将如何处理即将到来的Jak抑制剂其他适应症的批准决定尚未可知,但该监管机构似乎再次采取了非常谨慎的立场。虽然任何Jak抑制剂的限制很可能会产生一些直接受益者,但那些在新机制的开发者应该确定的是:FDA对新药安全性门槛是否正在上升?目前似乎还没有明确答案。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..