昨日,FibroGen 宣布收到美国 FDA 的完整回应函 (CRL),针对罗沙司他的新药上市申请(NDA)。该信函指出,以目前的数据情况,FDA 无法批准该药。珐博进需要进行另一项新的临床试验后再重新提交申请。
FibroGen 首席执行官 Enrique Conterno 表示:「我们对这一结果深感失望,对于美国患有 CKD 贫血的患者来说,这是不幸的一天。」
从 First-in-class,到数据争议,再到上市遭拒
罗沙司他(Roxadustat)是一种口服小分子缺氧诱导因子脯氨酰羟化酶 (HIF-PH) 抑制剂,是 CKD 贫血症领域的首个 HIF-PH 抑制剂,有望改变该领域的治疗现状。罗沙司他通过增加促红细胞生成素的内源性产生、改善铁的吸收和动员以及下调铁调素,从而促进红细胞的产生。同时,珐博进还正在开发该药用于与骨髓增生异常综合征 (MDS) 相关的贫血和化疗引起的贫血 (CIA)。

这款药本来在各方期待的潜在「重磅炸弹」,不过遗憾的是,这款药的上市之路并不顺利。今年 4 月,珐博进发表声明,承认更改了用于分析罗沙司他在慢性肾脏病贫血患者的心脏安全性数据的参数,以使其看起来更具优势。虽然更正后的新数据并没有改变以前对于透析和非透析患者使用罗沙司他的非劣效性结论,但其心脏安全性优势可能不复存在。
该消息传出后,珐博进股价暴跌 43%。
在二季度业绩电话会议上,首席执行官 Enrique Conterno 表示对安全数据错误「直接负责」的人不再与公司有关。该公司计划对临床数据管理、编程、分析和报告进行独立的质量监督。
7 月 15 日,珐博进宣布了 FDA 咨询委员会对 Roxadustat 治疗慢性肾病贫血的审查结果。经过一天的投票表决,FDA 心血管和肾脏药物咨询委员会(CRDAC)建议不批准罗沙司他的上市申请。对于非透析依赖(NDD)慢性肾病(CKD)患者,委员会以 13 票对 1 票反对;对于透析患者(DD),委员会以 12 票对 2 票反对。这一比例几乎是压倒性的。
今日,根据珐博进公告,FDA 正式拒绝了罗沙司他的上市申请。
中国首先批准,日韩已获批,欧洲即将获批
罗沙司他目前已经在中国、日本、韩国以及智利获批上市,全球首批在中国。2018 年 12 月 17 日,NMPA 批准了罗沙司他的上市申请。目前,国内还有 3 家企业迅速布局了罗沙司他仿制药,已启动 BE 试验。想了解罗沙司他在中国的审评历程?戳这里
罗沙司他国内布局企业
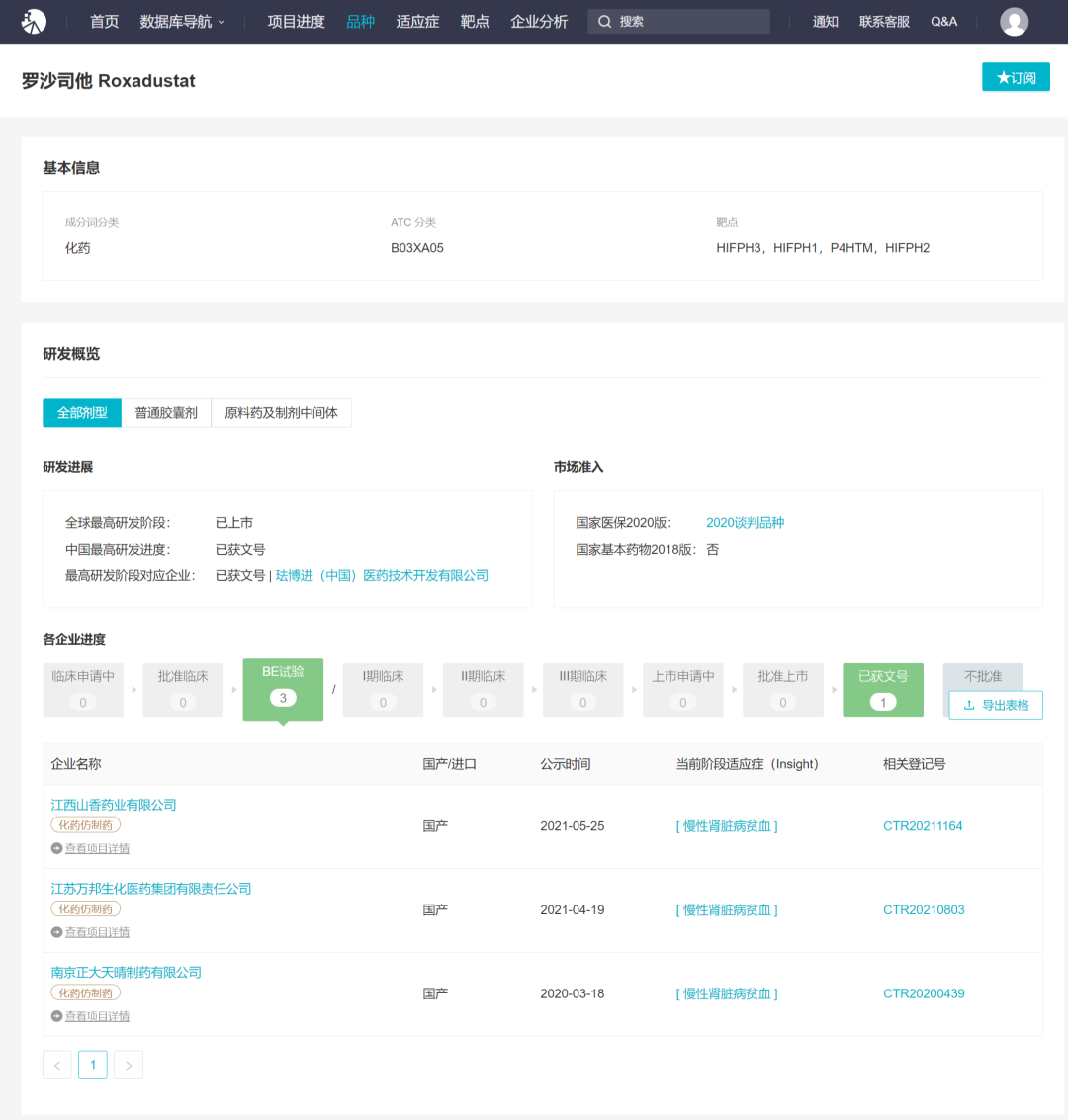
来自 Insight 数据库(http://db.dxy.cn/v5/home/)
珐博进 8 月 9 日发布的第二季度财务报告显示,罗沙司他 2021 Q2 在中国的净产品收入为 1340 万美元,其中包括向其分销商的销售收入以及珐博进中国的直接销售收入;Q1 这部分销售额为 1540 万美元。上半年,珐博进以及由珐博进和阿斯利康共同拥有的经销商在中国的罗沙司他总净销售额达到 9630 万美元,按当前汇率算,折合人民币 6.23 亿元。
珐博进 CEO Conterno 表示,在中国,FibroGen 的商业合作伙伴阿斯利康拥有强大的市场能力,正在扩大该药物的覆盖范围。截至 6 月底,罗沙司他已经覆盖了中国约 81% 具有慢性肾病贫血市场机会的医院。
而在欧洲,根据珐博进的公告,目前欧洲药品管理局人用药品委员会 (CHMP) 已提出积极意见,预计将在本月底做出决定。珐博进 CEO 表示,期待欧盟委员会根据 CHMP 的积极意见批准该药上市,从而使这一重要地区的患者得到这种新疗法。
此外,珐博进预计在第三季度将获得该药物的 II 期 Whitney 研究的数据,在 2022 年下半年或 2023 年上半年获得 Roxadustat 在 MDS 贫血中的 III 期 Matterhorn 研究的顶线数据。
针对罗沙司他,珐博进已经与多家企业达成合作。在日本、欧洲、土耳其、俄罗斯和独立国家联合体、中东和南非等不同市场,珐博进正与安斯泰来合作开发和商业化罗沙司他;在美国、中国、美洲其他市场、澳大利亚和新西兰以及东南亚,珐博进与阿斯利康合作开发这种药物。
肾病治疗药物的「灾难月」?
七八月份堪称是肾病治疗药物的「灾难月」,不止一款同类产品上市申请受挫。
7 月 19 日,Ardelyx 公司的 NHE3 小分子抑制剂 Tenapanor 收到 FDA 的反馈信函,表示这款药物用于透析成人慢性肾病(CKD)患者血清磷控制的新适应症上市申请具有缺陷,不适宜批准。消息披露当日,Ardelyx 股价暴跌 73.9%。
○ 详情可见 Insight 往期报道:Tenapanor 慢性肾病适应症上市受挫,Ardelyx 股价暴跌 73.9%
7 月 29 日,Ardelyx 公司收到了 FDA 的 CRL,拒绝了该产品这项新适应症的上市申请。FDA 认为该产品「获益小且临床意义不明确」。随后,Ardelyx 公司紧接着宣布裁掉该产品线 83 名员工,约占其员工比例的 33%。新药研发有风险,如此的失败更是伤筋动骨。
而珐博进是否也会调整产品策略?在公司未有消息披露之前都尚且未知,不过珐博进针对该产品的重点已经转移到了美国之外。在 FDA 拒绝的情况下,CEO Conterno 在电话会议上承认 FibroGen 将不得不「基本上重新评估我们的优先事项并重新分配我们的资源」。
四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..