|CRO投票活动「战况播报」|
截止6月16日17:00时,206家企业报名参赛,访问量达100万+,投票7万+,25家企业票数过千。泰丰研究院以4215票暂居研发CRO榜首,海河生物、天勤生物紧随其后;CDMO榜人气Top3 暂为以岭万洲、南京海纳、成都圣诺生物。
扫码参与投票、抽奖,每天可投3票,华为手机、平板电脑、刺绣工艺品、太极水卡、精品图书...万元大奖等你来抽!
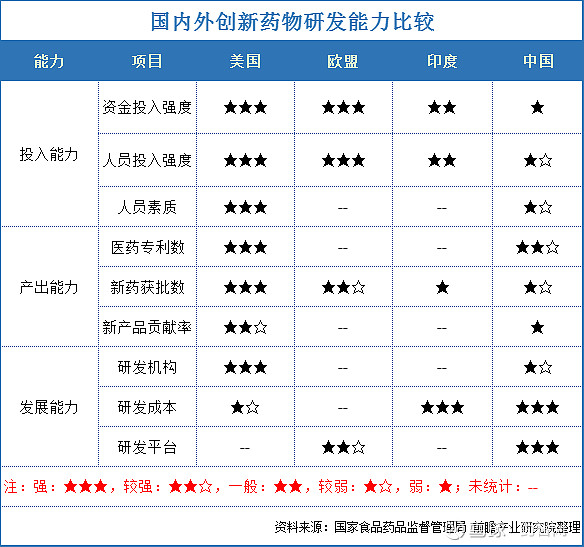
创新药的数量和质量代表一个国家的创新能力,也是国家经济的增长点。目前我国已成为世界第一大原料药生产和出口国、第二大非处方药市场及第三大医药市场,但我国的新药研发与欧美国家相比相对薄弱。2020年,美国CDER总共批准53个新药,欧盟EMA共批准42个新药,中国NMPA共批准48个新药上市,其中国产新药20个(比2019年增加6个),进口新药28个。
与发达国家相比,在许多指标上我国创新药物研发仍处于明显劣势。无论是研发投入能力还是产出方面与发达国家均有一定差距。本文通过对比我国与美国I类新药相关政策与临床研究审批等方面的差异,发现可借鉴的药物临床研究审批经验,促进我国新药研究发展。
中美新药定义的差异
药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质。
由于经济发展水平不同,中美两国对新药的定义也略有不同。
美国新药定义
美国食品药品监督管理局(Food and Drug Administration)[1]对新药的定义是“凡在1938年的《食品、药品和化妆品法》(Federal Food, Drug, and Cosmetic Act)公布后提出的任何具有化学组分的药品,其说明书中提出的用途未被经培训并有评价经验的专家普遍承认其安全性和有效性的;或虽其安全性和有效性已被普遍承认,但尚未在大范围或长时间使用的,称为“新药”。
中国新药定义
2015年8月以前我国对新药的审批按照《药品注册管理办法》[2]执行,其中对新药明确阐述为“未曾在中国境内上市销售的药品的注册申请”;“对已上市药品改变剂型、改变给药途径、增加新适应证的药品注册按照新药申请的程序申报”;“生物制品按照新药申请的程序申报”。
通过对比可见,我国新药申请范畴相对较宽,新药申请程序不仅包括创新药物的申请,还包括按新药申请程序的仿制药物的申请。2015年8月18日国务院颁布了《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称《意见》),其中将新药明确定义为“未在中国境内外上市销售的药品”[3]。并将新药分为创新药和改良型新药。此改变反映了我国在新药审评制度方面逐渐与国际接轨,将有力促进我国创新药物的研制。

中美新药审评的差异
我国医药产业发展较快,药品质量和标准不断提高,公众用药需求得到较好的满足。但同时,药品在审评过程中存在的问题也越来越凸显。中美两国对新药审评的不同主要体现在以下几个方面:
审评程序和申报机制的差异
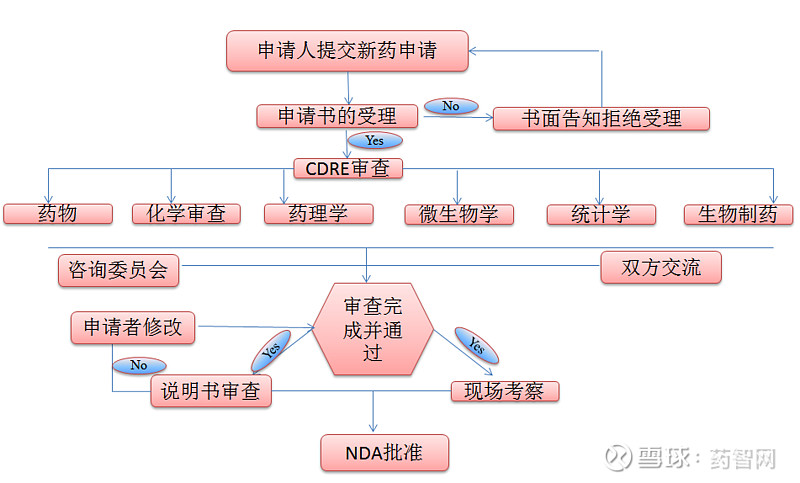
FDA采取直接申报、一级审评的申报机制。美国药物审评研究中心对新药申请(New Drug Application,NDA)的申报资料要求[4],首先进行60天的初审(其中包括形式审查),对于形式审查不合格或技术内容存在明显缺陷的申报资料一律不受理而退审,通过初审后的NDA直接进入复审(其中包括技术审查)。
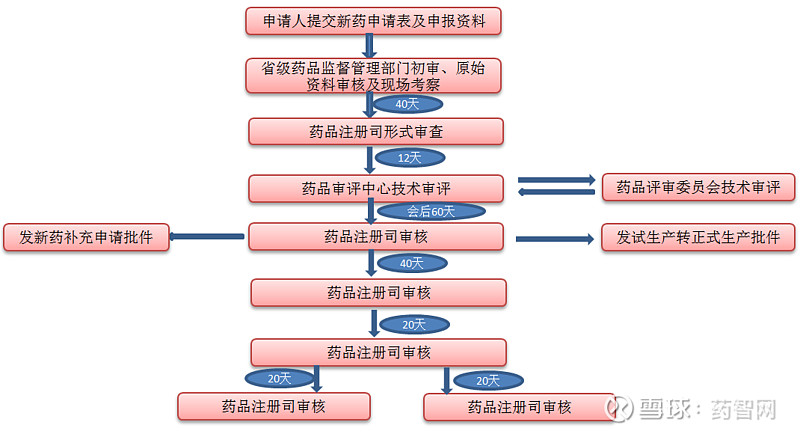
在我国负责新药评审的管理机构是国家药品监督管理局药品审评中心(CENTER FOR DRUG EVALUATION,NMPA CDE)。我国采用的是多次申报、二级审评的审评机制。省级药品监督管理部门负责形式审查和初审,上报国家药品监督管理局后,“受理办”进行再次形式审查。我国的初审(省级)和终审(国家级)不是同一批审评人员(FDA初审和终审工作均为同一批审评人员),这样在审评工作中的审评规则不尽相同,而且两次初审必然会产生审评周期长、审评效率低、审评成本高等一系列问题。如何适应我国的国情,改变现有的审评程序、申报机制将是一项艰巨的任务。
美国新药申请
中国新药申请
审评原则的差异
FDA对于申请进行临床研究(investigational newdrug,IND)的药品技术要求比较宽松,只要有初步的质量、药效和动物药代动力学研究资料,能够简单说明无严重的安全性问题,就可批准进行临床研究。美国新药申请的退审阶段主要集中在I期和II期临床研究,尤其是在II期临床研究之后,新药的淘汰率较高。
我国恰好相反,我国新药退审主要集中在申请临床试验阶段[5]。临床前研究的实验对象是动物,从动物身上获得的试验数据虽然对药物的评价有一定的参考作用,但真正评价一个药物是否安全有效的主要依据应是从临床试验中获得的数据,临床研究才是评价新药安全有效的关键阶段,是决定药物能否批准上市的试金石。
再评价机制的差异
药物再评价是对市场药物进行安全性或有效性评价的研究,是评价药物安全有效性的一个重要组成部分,也是NDA申请审评的一个重要方面。药物是否真的安全有效,只有在药物上市后,通过大范围的人群长时间使用来验证。
美国对于上市新药有非常健全的再评价机制[6],其工作内容包括药品不良反应报告和监测制度、定期报告制度、上市后临床试验及研究制度三部分,在再评价体系下,FDA对上市后药品的安全风险进行实时监测,以期有效控制风险。
2015年9月10日,国家食品药品监督管理总局发布的《药品不良反应报告和监测检查指南(试行)》。2018年,我国“药品上市许可持有人药品不良反应直接报告系统”正式出台,药品生产企业将通过该系统上报不良反应。2020年我国根据《中华人民共和国药品管理法》及《中华人民共和国疫苗管理法》,制定《药物警戒质量管理规范(征求意见稿)》,进一步规范了药品全生命周期药物警戒活动[7]。这为掌握新药上市后的用药安全提供了很好的依据。我国已逐渐向发达国家靠拢。
中美新药研究申请程序异同
相同点:
中美两国新药研究申请程序相同点有:申请新药注册都必须进行临床试验申请和伦理委员会的审查,对不符合要求的申请都可能导致程序的终止。
差异:
美国的新药临床试验申请评审[8]主要包括两个阶段:第一阶段是对申报资料进行形式审查,第二阶段是对药品安全性和有效性进行实质性审查和技术性评价,两个阶段皆由美国FDA下设的药品评价和研究中心(CDER)审查。
FDA的评审效率相对更高,我国新药临床试验的技术评审时限为90个工作日,美国为30个工作日。我国新药临床试验的许可程序包括形式审查、现场核查、初步审查和技术评审等环节;美国审核程序简单,CDER将IND审评重点放在安全性上,FDA收到IND申请自30日内未作出暂停临床研究的决定,即视为默认同意,申请人即可开展临床研究。
FDA认为IND申请资料有微小缺陷,申请人甚至在对缺陷进行整改的同时进行临床试验。暂停临床研究超过1年或更长时间,并不必然导致新药临床试验申请的失效,可以IND转入“静止状态”。只有当“静止状态”超过5年以上才可能导致终止。由此可见,美国临床审评的过程是一个动态过程,即对临床试验过程中遇到的安全性问题(包括没有在预想范围内的),临床审评员要不断做出判断并反馈给申办者。
FDA对药物临床试验申请审查不是很严,申报的机会更多、门槛更低、行政许可通过率更高。在研究过程中,FDA可以随时发现与研究发起人进行有关IND不足之处或FDA需要更多数据信息的口头或书面交流,这种交流活动一般视为“建议”,无需要更改计划或正在进行的临床研究项目,发起人也无需答复FDA。
我国新药临床申请由国家和省级药监管理部门两级负责受理和审批,省级药监局负责形式审查,国家药监局负责终审。申请者必须经国家食品药品监督管理局批准后,获得药物临床试验批件后方可开展临床试验。申请者需要提交审查综述、药学研究、药理毒理研究、临床试验等有关资料,同时要求所有材料在I期临床试验前提交,且在4个月内一次性补齐所有材料。
总体来说,我国对临床研究申请所需提交的资料要求相对严格,这与我国以仿制药开发为主的行业背景有关。对仿制药来说,不论是药学研究资料还是药理毒理资料均已有前人的研究经验,申报者只要收集、模仿,按要求提交即可。但对新药(尤其是完全创新药)来说,临床试验还只是探索性的阶段,许多研究数据(如长期毒性资料)还有待在后期研究中总结发现。因此,要求申报者在I期临床前需提交上述资料,此时耗费大量的时间和精力,从而影响了新药临床试验审批的效率。
中美新药非临床研究申请异同
为申请临床研究而做的非临床研究中,中国一般包括药理学、主要药效学和药代动力学。而美国对动物研究方面比中国要宽。在毒理学研究方面,中国规定做急性毒性和长期毒性试验,而美国则做急性、亚急性和慢性三种9全身毒性试验。对于遗传毒性,中国要求只有当确实需要通过动物长期给药研究评价人体中药物暴露所致的潜在致癌性时,才应进行致癌试验[9]。美国则要求,凡致突变试验阳性或人体使用累计达三个月以上的药物必须做致癌试验。

中美新药临床研究申请异同
相同点:

在美国,新药临床申请试验分为商业性和非商业性两类。非商业性申请目的分为研究性、急救性、治疗性新药临床试验申请,此类申请高于商业性申请。而我国新药临床研究申请主要目的是商业性的,即申请新药通过临床研究,最终投入生产销售
。

中美新药优惠政策的差异
为了鼓励新药研发和对知识产权的保护,中美两国对所研发的新药均有优惠政策。
美国市场独占权:
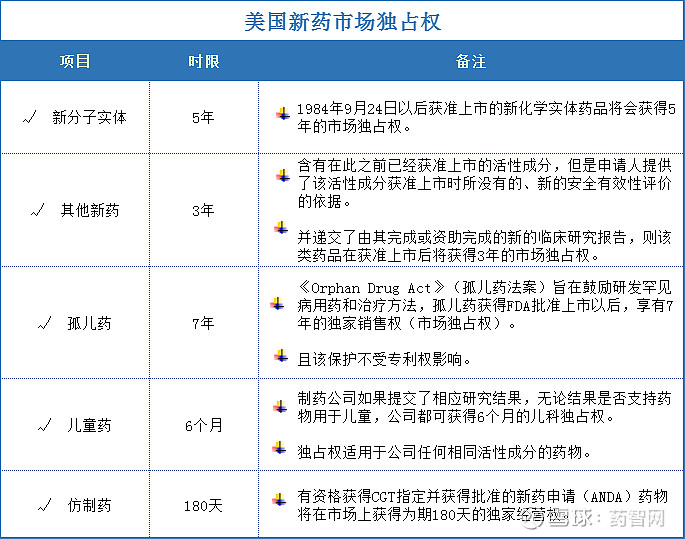
中国:
设立了对新药品种3-5年的新药监测期。在新药监测期内,其他药品生产企业不得生产相同品种的药品。
此外,中美两国在加速审评审批方面也均有一定的政策鼓励[10]。
中国新药上市加快审评审批政策包括4种类型,分别是特别审批、特殊审批、优先审评、有条件批准。由于“特别审批”涉及重大突发卫生公共事件,满足条件的品种很少,因此,通常情况下中国新药上市加快审评类型可以归纳为3种,分别是特殊审批、优先审评、有条件批准。
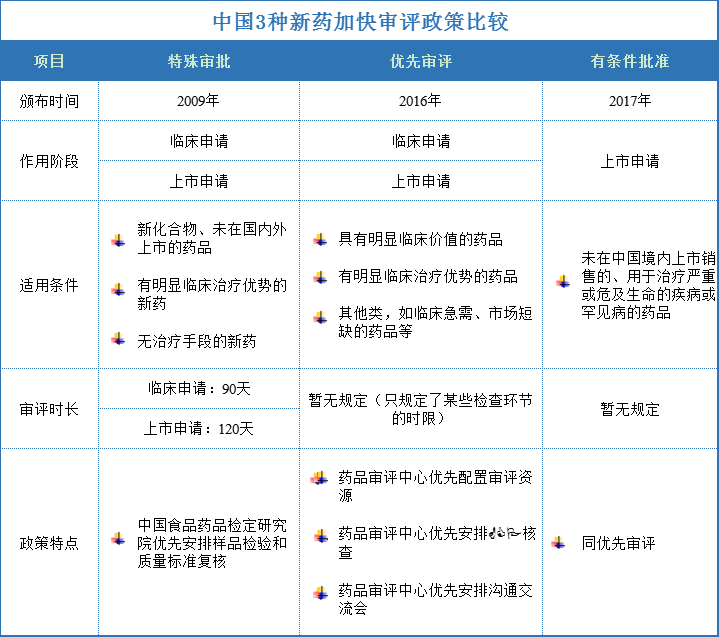
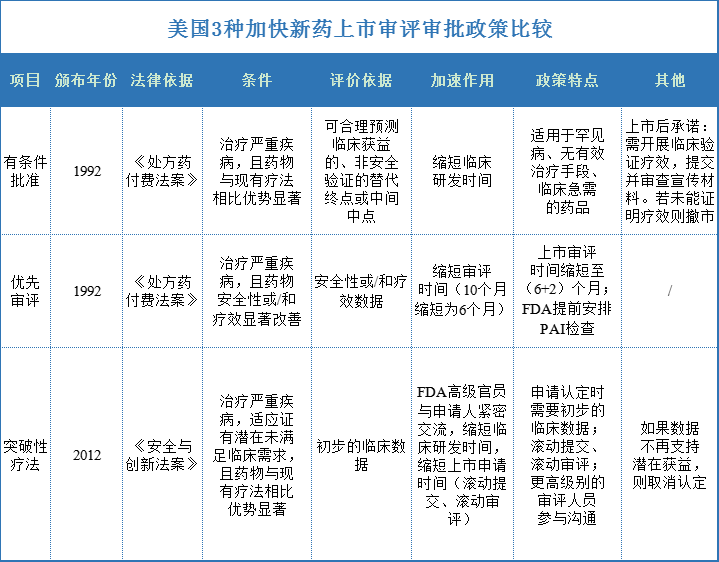
美国的新药上市加快审评审批的政策有3种,分别是突破性疗法(breakthrough therapy)、优先审评( priority review)、有条件批准(accelerated approval)。
总结
2017年以来,我国医药行业的政策监管愈发严格,药品注册申请的要求也越来越完善,不管是仿制药、新药还是补充申请都要严格符合注册法规的相关要求,提供完整、真实且可溯源的全套药学研究、非临床研究和临床研究资料,促进了国内医药行业发展从粗放式向精细化的转变,逐步与国际接轨。
提升医药产业创新能力,鼓励发展创新药物,是国家医药产业实现跨越式发展的核心引擎。美国作为世界上新药研发能力最强的国家,其新药研发的成功经验,对我国具有很大的借鉴意义。学习和借鉴发达国家的成功经验,克服不利因素,以更加积极主动的姿态投入到创新药物的研发中,以实现我国医药产业跨越式发展。
作者:药智网
链接:https://xueqiu.com/5964803315/183216882
来源:雪球
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
风险提示:本文所提到的观点仅代表个人的意见,所涉及标的不作推荐,据此买卖,风险自负。
参考文献:
[1]https://www.ecfr.gov/cgi-bin/text-idx?SID=a5e13772d51b5900dec2f52bb91c32e9&mc=true&node=se21.5.310_13&rgn=div8
[2]https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/bmgzh/20070710010101571.html
[3]https://www.nmpa.gov.cn/directory/web/nmpa/zhuanti/lshzht/fzhypj/fzhyzhcfg/20150818101201803.html
[4] https://www.fda.gov/medical-devices/premarket-approval-pma/pma-review-process
[5]余菁菁. 中美新药审批制度的比较研究:一个经济学的视角.
[6]张琪, 颜建周, 马旭峰, 等. 美国药品上市后再评价法律制度实施的研究及其对我国的启示[J]. 中国药房, 2019, 30(15): 2017-2022.
[7]《药物警戒质量管理规范(征求意见稿)》.
[8]https://www.ecfr.gov/cgi-bin/retrieveECFR?gp=&SID=9d8edd80fb9c9d2e7149351a66421212&mc=true&n=sp21.5.312.b&r=SUBPART&ty=HTML#se21.5.312_122
[9] https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20100401145801553.html
[10]任晓星, 史录文. 中美欧新药上市加快审评审批政策研究[J]. 中国新药杂志, 2020, 29(9): 9621-971.









