5 月 21 日,FDA 发布公告,加速批准强生 Rybrevant(amivantamab-vmjw)用于铂类化疗后进展的 EGFR 外显子 20 插入突变的转移性非小细胞肺癌(NSCLC)患者。这是该突变类型首个获批的治疗药物,同时获批的还有其辅助诊断剂 Guardant360 CDx(Guardant Health Inc.)。
该项批准基于 CHRYSALIS 研究的数据。CHRYSALIS 是一项多中心、非随机、开放标签、多队列的临床试验(NCT02609776),纳入了 81 名在铂类化疗中或治疗后疾病进展的 EGFR 外显子 20 插入突变的局部晚期或转移性 NSCLC 的患者。患者每周接受一次 amivantamab-vmjw,持续 4 周,然后每 2 周接受一次,直到疾病进展或出现不可接受的毒性。
其主要疗效终点指标是 BICR 根据 RECIST 1.1 评估的总体缓解率(ORR)和缓解持续时间。结果显示,ORR 达到 40%(95%CI:29%,51%),中位缓解时间为 11.1 个月(95%CI:6.9,NE)。
最常见的不良反应(≥20%)是皮疹,与输液有关的反应,甲沟炎,肌肉骨骼疼痛,呼吸困难,恶心,疲劳,浮肿,口腔炎,咳嗽,便秘和呕吐。
Amivantamab(研发代号:JNJ-61186372)是强生研发的 EGFR/c-Met 双抗,2020 年 3 月,该药获得 FDA 突破性疗法认证;10 月,在中国获得突破性疗法认证。
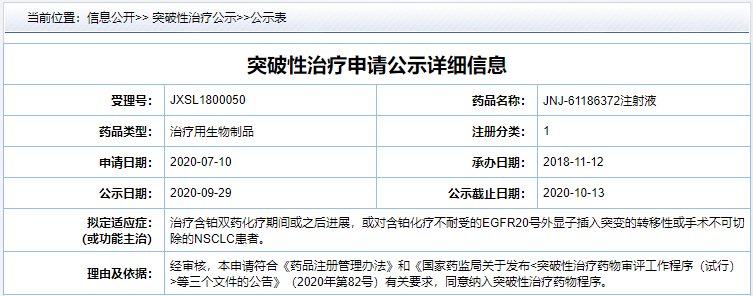
来自:CDE 官网
根据 Insight 数据库,强生在去年 12 月即在国内启动了 EGFR/c-Met 双抗 Amivantamab 的 III 期临床,联合第三代 EGFR 抑制剂 Lazertinib 一线治疗晚期不可切除的 NSCLC。与 Amivantamab 联合用药的 Lazertinib 同样由强生研发,是一款第三代 EGFR 小分子抑制剂。
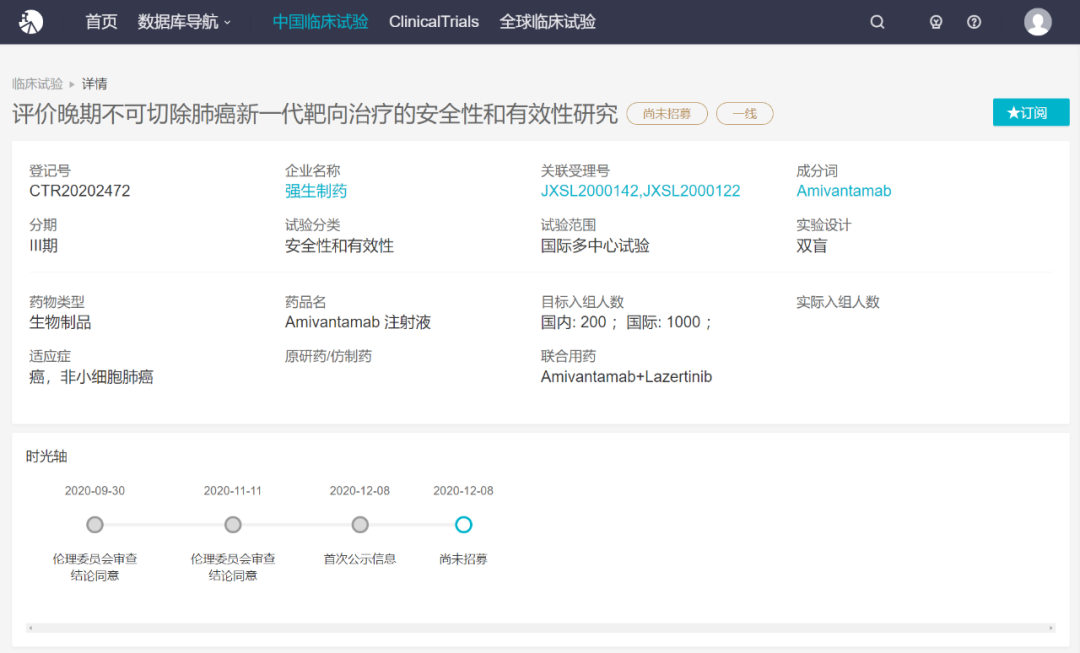
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
目前在国内,EGFR/c-Met 双抗还有贝达药业和岸迈生物在临床开发中,两家均已启动 1 项 I/II 期临床。
EGFR/c-Met 双抗国内进度概览(Insight)

关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..