如果将同样一个处于早期的分子交给两家不同的公司,谁是最好的选择? 选择组织架构完善的跨国MNC,还是如Seagen、Incyte这样的海外创新公司,亦或是百济神州?
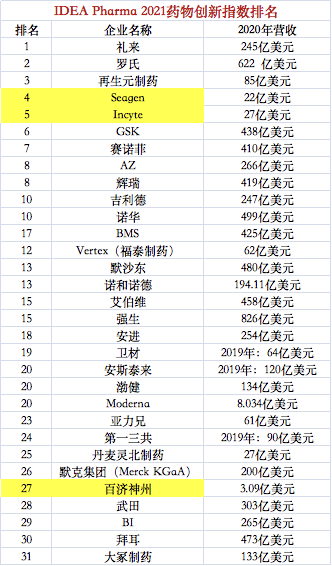
近日,行业咨询公司IDEA Pharma发布的年度药物创新指数和药物发明指数给了参考。其榜单中排名前30的公司,目前正在进行2200余个临床试验。
今年是IDEA Pharma发布药物创新指数的第十个年头,该指数不仅仅着眼于制药公司的获利能力,更注重药企的创造创新能力,以为未来发展打下坚实的基础。也就是,更注重谁能更成功地将一个早期阶段的临床项目,变成具有影响力的新药。在此次创新指数榜单中,礼来上升4位,突破重围,首次荣登榜首。不过IDEA Pharma认为礼来在未来几年内,仍可能继续在药物创新和发明指数上保持前十名的位置。
对于礼来夺冠的主要原因IDEA Pharma归结于,大量积极的临床结果以及稳健的财务数据。
2020年礼来实现收入近246亿美元,比上年增长10%。在研发方面,礼来有多款重磅药物有了巨大进展,如偏头痛药物Emgality,推出了关键的差异化数据;Tauvid被批准用作阿尔茨海默症诊断剂,是第一个也是唯一一个被批准用于在大脑中对tau NFT成像的诊断剂;Cyramza与厄洛替尼组合疗法获FDA批准,成为EGFR突变的非小细胞肺癌的一线治疗药物等等。
而其他MNC中,罗氏下降一位,位列第二。诺华和默沙东分别下降了7名、6名。赛诺菲上升了10个名次,位列第7。
值得关注的是,在该榜单中,有这样两家营收不足30亿美金的公司,Seagen(第4)和Incyte(第5)首次入围该榜单,却直接杀入前五名。
2019年底IDEA Pharma首次发布了药企发明指数排名,该指数是业内首份以在研管线为主要研究标准的榜单,主要综合当年公司研发管线中在研疗法的数量与已经上市药物数量的比例、处于临床试验阶段的创新药物数量、在研疗法中获得“创新”监管资格认定的比例、研发投入四个关键标准而得出。此次,BMS勇夺药企发明指数排名桂冠,其主要原因则是通过收购Celgene不仅大大扩展了其产品线,还获得了新的重磅炸药。
值得关注的是,百济神州成为唯一入围两大指数榜单的中国创新药企。在创新制药指数排名中位列第27名,在年度发明指数中,百济神州的排名超越GSK、赛诺菲这样的跨国药企,名列第5位。
尽管两大指数每年都会有所变化,但是已经显示出这样一个趋势,与规模较小的制药公司相比,大型制药企业正在逐渐失去生产突破性药物的能力。一个较大的公司可能具有更大的市场规模和更好的基础架构,但它可能并未播下未来增长的种子,或至少不像以前那样多。
以下为创新指数和药企发明指数TOP10新入榜企业介绍:
Seagen:3款肿瘤产品齐发
Seagen(西雅图遗传学公司),是首次跻身在药物创新和发明指数中,在药物创新排名中位居第4名,在发明指数排名中位列第22。
Seagen在2020年营收实现了为22亿美元,增长了137%。这家公司有3种上市的肿瘤产品:抗体药物偶联物Adcetris和Padcev,以及新批准的同类最佳TYK抑制剂Tukysa。此外,Seagen管线中还有9款候选对象,其中两个处于后期开发阶段。
去年,Tukysa获得欧洲药品管理局(EMA)推荐联合曲妥珠单抗和卡培他滨,用于治疗先前已接受过至少2种抗HER2方案的局部晚期或转移性HER2阳性乳腺癌患者。
近日,Seagen与安斯泰来联合宣布,FDA已受理抗体偶联药物(ADC)Padcev(enfortumab vedotin)治疗尿路上皮癌(UC)的2份补充生物制品许可申请(sBLA),将作为实时肿瘤学审查(RTOR)试点项目的一部分进行审查。

Padcev是首个获批治疗UC的ADC药物,也是首个获批用于先前接受过含铂化疗和一种PD-1或PD-L1抑制剂的局部晚期或转移性UC患者的药物。在今年3月Padcev已经在欧盟和日本申请上市。如果获批,该药将成为欧洲和日本第一个针对UC的ADC药物。
Incyte:中国创新药企老朋友
Incyte尽管是药物创新和发明指数的新面孔,但是亮相排名都相当靠前,创新指数位居第5,发明指数位列第2。
Incyte已经有30年的历史,其官网显示已有6款药物上市。2020年Incyte的总收入增长了24%,主要原因是其重磅炸弹药JAK抑制剂Jakafi贡献了产品净收入的15%。Jakafi在2020年的收入接近20亿美元,并且预计销售峰值将达到30亿美元。
在2020年Incyte和诺华启动了Jakafi针对COVID-19的第二项III期临床试验,以评估Jakafi联合标准护理(SoC),在需要机械通气的急性呼吸窘迫综合征(ARDS)COVID-19患者中的安全性和有效性。
另外,Incyte和礼来的另一种JAK抑制剂Olumiant在特应性皮炎患者中获得了III期阳性结果。不过未来将面临来自赛诺菲和再生元的Dupixent的竞争。
在2020年,Incyte和MorphoSys联合宣布Monjuvi联合来那度胺,用于治疗不适合自体干细胞移植(ASCT)的复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者获得
FDA批准
2020年其Pemazyre也率先获得美国FDA批准,用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者。Pemazyre是第一个也是唯一一个获美国FDA批准用于治疗胆管癌的靶向药物。
Incyte也是中国创新药企的老朋友,早在2018年,信达生物就和Incyte公司达成战略合作和独家授权许可协议,引进Pemazyre的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。
还有再鼎,2019年,再鼎与Incyte达成合作和许可协议,以在大中华地区开发研究PD-1抗体retifanlimab并将其商业化。
百济神州:将进入全球收获期
中国创新药企先锋开始被关注到。在外媒的相关报道中称,“欧洲鲜为人知的中国的新兴生物技术公司在一些优势领域赶超了GSK或赛诺菲这样的主流大公司”。
与Seagen和 Incyte相比,作为唯一入选药物创新和发明指数的中国公司,百济神州略显年轻。在创新指数排名中,百济神州位列第27名,在发明指数排名中位列第5。
2020年百济神州全年实现产品销售收入3.09亿美元,研发投入再创新高,研发费用总计12.9亿美元(约合人民币83亿元),超过了恒瑞医药。
2020年,百济神州自主研发的产品开始进入商业化阶段,替雷利珠单抗于去年3月份开售,上市首年实现销售额1.63亿美元(约合人民币10亿元),与其他几个国产PD-1的销售体量差距逐渐缩小。泽布替尼是其第二款商业化产品,去年在全球实现销售额约4170万美元(约合人民币2.69亿元)。
百济在全球约30个国家同步推进临床试验,泽布替尼已在全球递交超过20项上市申请,覆盖五大洲40多个国家和地区;替雷利珠单抗(PD-1单抗百泽安)除了已获批的3项适应症及2项正在审评中的上市申请,还有10项临床试验已进入临床3期,并将在2021年在海外市场递交首项上市申请;PARP抑制剂帕米帕利预计于2021年上半年在中国获批。
2021年百济神州有望在全球范围进入集中收获期,到2021年底,预计将有至多12款抗肿瘤商业化产品。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..