CAR-T细胞疗法是最具创新性的基因疗法之一。该疗法主要用于治疗血液癌症,将患者的T细胞提取并修饰为CAR-T细胞,以精确地攻击癌细胞。如今,随着CAR-T细胞疗法在全球陆续获得批准,国内近期有望迎来该类药物的上市。
5款CAR-T细胞疗法在美获批
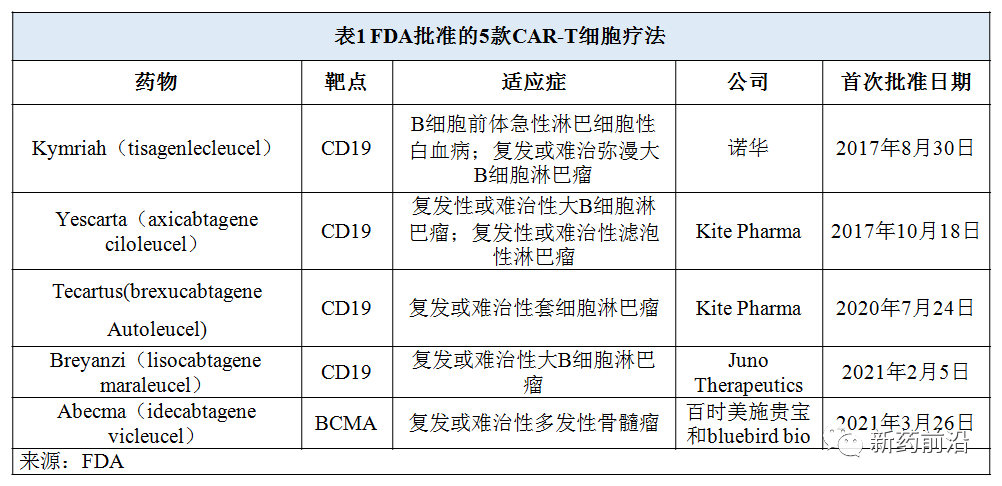
目前,已有5款CAR-T细胞疗法在美国获FDA批准上市。
01Kymriah(tisagenlecleucel)
2017年8月30日,FDA批准第一款基因疗法——诺华的Kymriah(tisagenlecleucel),用于急性淋巴细胞白血病(ALL)儿童和年轻成人患者。Kymriah的安全性和有效性在一项针对63名患有复发性或难治性B细胞前体ALL的儿童和年轻成人患者的多中心临床试验中得到了证明,治疗三个月内的总缓解率为83%。
2018 年 5 月 1 日,Kymriah 获批第二个适应症,用于治疗复发或难治性大B细胞淋巴瘤的成人患者(先前接受过两次或以上的系统治疗),其中包括最常见的非霍奇金淋巴瘤形式—弥漫性大B细胞淋巴瘤(DLBCL)以及起因于滤泡性淋巴瘤(FL)的高级别B细胞淋巴瘤和DLBCL。
02Yescarta(axicabtagene ciloleucel)
2017年10月18日,第二款CAR T细胞疗法问世,Kite Pharma(已被吉利德收购)的Yescarta(axicabtagene ciloleucel)获得FDA批准用于治疗经过两次或以上系统治疗的复发性或难治性大B细胞淋巴瘤的成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL),原发性纵隔大B细胞淋巴瘤,高级别B细胞淋巴瘤和滤泡性淋巴瘤引起的DLBCL。
2021年3月5日,Yescarta获得FDA批准用于经过两次或以上系统治疗的复发或难治性滤泡性淋巴瘤(FL)的成年患者,该批准使Yescarta成为第一种被批准用于惰性滤泡性淋巴瘤患者的CAR T细胞疗法。
03Tecartus(brexucabtagene Autoleucel)
2020年7月24日,Kite Pharma第二款CAR-T细胞疗法Tecartus(brexucabtagene Autoleucel) 获得FDA批准用于治疗复发/难治性套细胞淋巴瘤(MCL)成人患者。
04Breyanzi(lisocabtagene maraleucel)
2021年2月5日,百时美施贵宝旗下Juno Therapeutics公司的Breyanzi(lisocabtagene maraleucel)获得FDA批准用于治疗经过两次或两次以上系统治疗的复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL)(包括惰性淋巴瘤引起的DLBCL),高级别B -细胞淋巴瘤,原发性纵隔大B细胞淋巴瘤和3B级滤泡性淋巴瘤。
05Abecma(idecabtagene vicleucel)
2021年3月26日,百时美施贵宝和bluebird bio公司宣布, FDA已批准Abecma(idecabtagene vicleucel; ide-cel)作为首款B细胞成熟抗原(BCMA)CAR -T细胞疗法,用于治疗四种或以上前期疗法(包括免疫调节剂,蛋白酶体抑制剂和抗CD38单克隆抗体)后复发或难治性多发性骨髓瘤的成年患者。
Abecma是获得FDA批准的首款靶向BCMA的CAR-T细胞疗法。BCMA是一种在多发性骨髓瘤的癌细胞上普遍表达的蛋白,它是这种侵袭性血液癌症的重要潜在靶点。其他4款CAR-T细胞疗法均是靶向抗原CD19,CD19是一种表达于多种血液肿瘤细胞表面的抗原蛋白,包括B细胞淋巴瘤和白血病细胞。
国内CAR-T细胞疗法开发
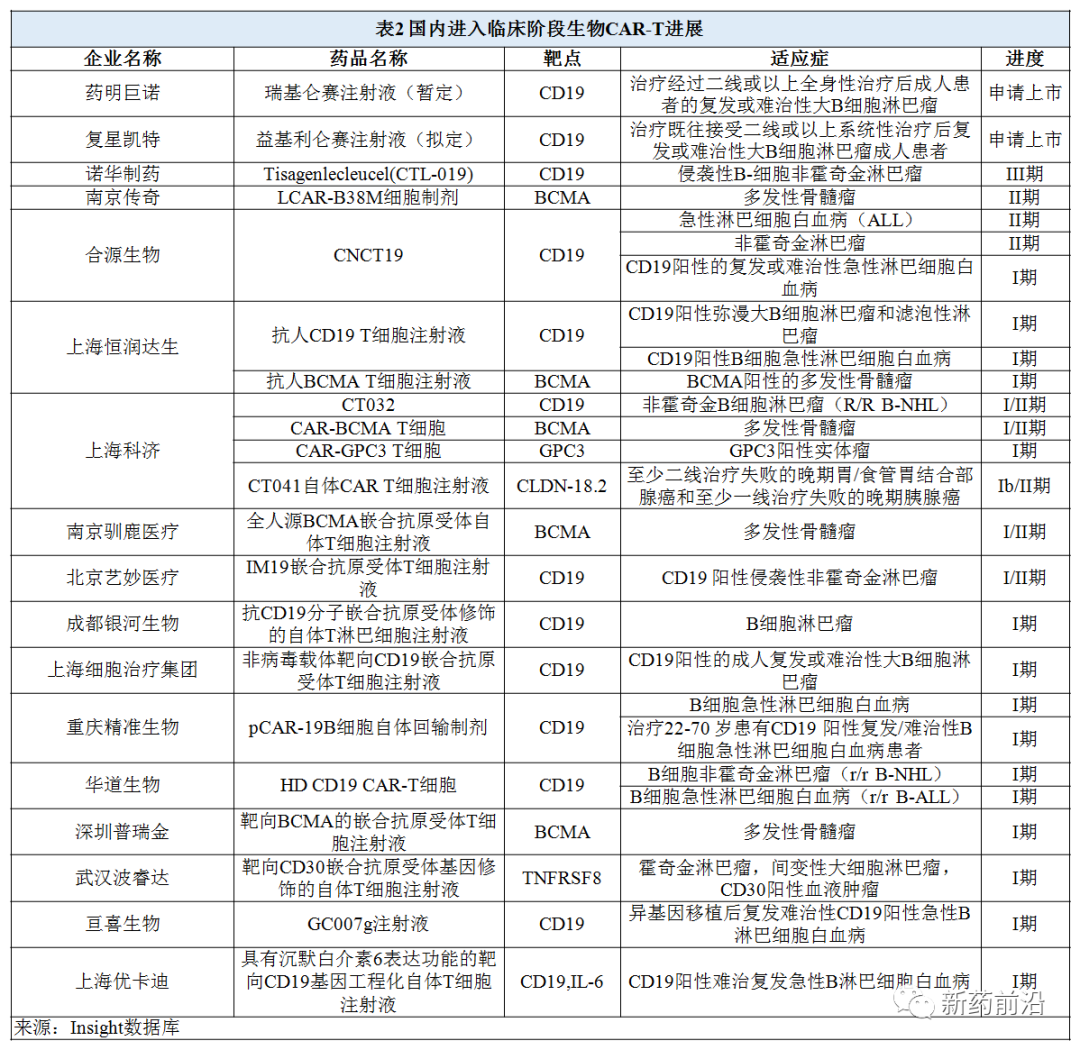
而在我国,尽管目前尚无CAR-T细胞疗法获批上市,不过从ClinicalTrials.gov上CAR-T细胞疗法临床试验注册登记数量的区域分布来看,中国已经超越欧美,成为当今世界上CAR-T细胞疗法临床研究数量最多的国家,不久的将来有望迎来多款CAR-T细胞疗法上市。
而国内CAR-T细胞疗法的开发主要通过合作引进开发、外企独自开发和国内企业自主开发三种模式。
01
合作引进开发
全球领先的CAR-T细胞疗法生物技术公司,通过与国内企业合资成立公司,优势互补,进行技术引进合作开发已成为快速进军中国市场的捷径。
Yescarta(益基利仑赛注射液,代号FKC876)由上海复星医药集团与Kite Pharma(凯特制药)成立的合资企业复星凯特生物科技有限公司(FOSUN Kite)开发。从2017年4月复星凯特生物科技有限公司引进Yescarta,到2020年2月FKC876新药上市申请获国家药品监督管理局(NMPA)正式受理,用时不到3年。该产品是复星凯特在中国推进商业化的第一款CAR-T细胞治疗产品,也是国家药品监督管理局正式受理上市申请的第一款CAR-T细胞治疗产品。FKC876已于2020年3月被纳入优先审评,用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。
2016年,药明康德和美国领先的CAR-T制药公司Juno Therapeutics(巨诺)成立合资公司药明巨诺,共同开展CAR-T和TCR(T细胞抗原受体)疗法的研发和生产。药明巨诺领先的主打产品JWCAR029(relma-cel,瑞基仑赛注射液)是针对复发或难治性B细胞淋巴瘤的三线治疗的抗CD19 CAR-T细胞疗法。瑞基仑赛注射液(即JWCAR029)是建立在Juno公司lisocabtagene maraleucel (liso-cel,JCAR017) 基础上,由药明巨诺自主开发的CAR-T产品。2020年6月中国国家药品监督管理局受理审查药明巨诺将relma-cel 用作弥漫性大B细胞淋巴瘤(DLBCL)三线疗法的新药上市申请,并于2020年9月授予新药申请优先审查资格。据悉,JCAR017与JWCAR029的区别仅在于,前者CD4与CD8分别生产,然后按1:1比例混合,后者则同时生产CD4、CD8 T细胞。
02
国内企业自主开发
2020年8月,南京传奇独立研发的 LCAR-B38M(cilta-cel)成为国内首个拟纳入突破性治疗药物程序的CAR-T细胞疗法品种。LCAR-B38M是一款靶向B细胞成熟抗原(BCMA)的CAR-T细胞疗法;2017年12月,强生旗下的杨森制药公司与南京传奇签订了一项全球独家许可和合作协议,以合作开发cilta-cel并将其商业化。2020年12月21日,杨森宣布开始向FDA滚动提交其研究药物B-ciltacabgene autoleucel(cilta-cel)用于治疗复发和/或难治性多发性骨髓瘤成年人的生物制品上市申请(BLA),并于近日完成提交,等待FDA批准中。3月FDA批准的Abecma是多发性骨髓瘤首个获得批准的CAR-T药物,也是B细胞成熟抗原靶向类中的第一个获批CAR-T药物的药物。 强生和传奇现在希望紧随其后。在去年下半年美国血液学会(ASH)年会上公布的最新数据中,两家公司揭示了其具有前景的II期数据,在三分之二的患者中消除了多发性骨髓瘤,在97%的患者中肿瘤缩小。
2020年12月23日,合源生物科技(天津)有限公司CNCT19细胞注射液(抗CD19的CAR-T细胞疗法)在我国获准纳入突破性治疗药物,适应症为复发或难治性急性淋巴细胞白血病。该项目在国内正在开展Ⅱ期临床试验研究。
此外,据Insight数据库信息,国内多家生物技术公司正在CAR-T细胞疗法开发,并且正在进行多种适应症的研究,甚至开始进入到实体瘤领域。
03
外企独自开发
作为CAR-T细胞疗法领域的主要领导者,实力雄厚的诺华选择在中国独自开发全球首款获批的CAR-T细胞疗法Tisagenlecleucel(CTL-019)。2019年8月12日,诺华在我国提交了CTL019的临床试验申请,已获得CDE受理。目前Tisagenlecleucel治疗侵袭性B细胞非霍奇金淋巴瘤成年患者的试验在国内正在开展Ⅲ期临床试验研究。
延伸阅读:临床应用的困境
作为一项革命性的技术,CAR-T细胞疗法广泛应用还面临着重重困难。
01
后勤问题
CAR-T细胞疗法的工作原理是首先通过一条静脉输液管线去除患者的血液。然后将包括T细胞在内的白细胞去除,然后再通过另一条静脉输液管线将血重新注入患者体内。去除后,将T细胞分离并送到实验室,在实验室中通过添加特异性嵌合抗原受体(CAR)对其进行遗传改造。通常需要几个星期才能完成治疗所需的大量T细胞的制备。
每种CAR-T细胞疗法的独特性质都会造成许多制造和后勤问题,而诺华公司就是其中一个面临重大困难的公司。2017年8月,诺华Kymriah获得FDA批准,但是截至2019年底,该公司仅将这些疗法运送给约1800名患有血液癌的患者。尽管患者数量似乎很少,但考虑到每种产品必须根据患者自身的免疫细胞进行个性化处理,这也是一个令人印象深刻的里程碑。该过程通常需要公司平均花费21天才能完成,由于需要治疗的患者往往病情严重,因此在时间上异常紧迫。
但是,由于规格或制造问题,诺华大约有10%根本无法正常供药。
另外,FDA对Kymriah的要求之一是,该产品至少包含80%的活T细胞,这已从临床试验中设定的70%阈值改变了,并且也比其他批准治疗的国家更高。这是由于FDA认为低于80%都可能造成安全隐患。该规定使诺华感到异常沮丧。
02
价格问题
无可否认,CAR-T细胞疗法是对以前治疗血液癌症方法的一种改进。在获得FDA批准之前,像淋巴瘤这样的疾病只能通过联合化疗方案来治疗。根据各种信息,CAR-T细胞疗法治疗可使约60%的患者长期持久缓解。
诺华的Kymriah的临床试验显示,对标准治疗无反应的白血病患者的缓解率达83%。吉利德的Yescarta也能使侵袭性B细胞非霍奇金淋巴瘤的缓解率达到72%。
但是由于CAR-T细胞疗法个性化和复杂的生物工程过程,开发成本预计会很昂贵。据各公司在美国产品定价,诺华Kymriah治疗白血病费用为47.5万美元;Yescarta治疗淋巴瘤费用为37.3万美元;Breyanzi治疗淋巴瘤费用为42.8363万美元。而新上市Abecma治疗多发性骨髓瘤费用同样不菲,为41.95万美元。
而且对于这个巨大的治疗价格是否真的具有成本效益还存在争议。
03
实体瘤适应症待攻克
尽管CAR-T治疗已被认为可以成功治疗血液癌症,但就治疗其他类型癌症如实体瘤而言,目前尚未取得实质性进展。
血液癌中的CAR-T治疗之所以行之有效,是因为它们是B细胞的恶性肿瘤,可以彻底清除掉,但是实体瘤没有B细胞等效物。静脉注射时,CAR-T细胞难以进入到实体瘤。更复杂的是,每种不同类型的器官都有不同的免疫微环境,这使得在不同类型的癌症患者中测试CAR-T成为一项挑战。
尽管如此,包括研究机构和生物技术公司,都在进行CAR-T治疗实体瘤进行各种研究。
CAR-T细胞疗法可能会改变癌症的治疗方式,并且在治疗血液癌症中的有限使用是成功的,但是其成本可能会限制该治疗方法的普及程度。
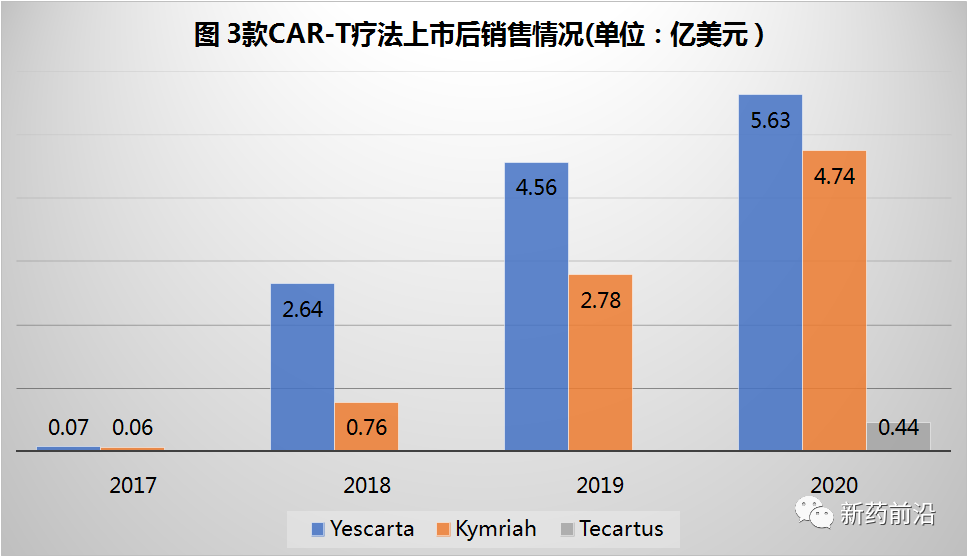
对制药公司来说,产品上市后的市场推广也同样面临挑战,如该领域2款于2017年批准产品上市3年后,2020年销售额为:吉利德的Yescarta在全球获得了5.63亿美元的收入,而诺华的Kymriah则获得了4.74亿美元的收入,这些销售数据与肿瘤领域的其他疗法(如小分子和单克隆抗体等)相比,可能算是表现平平。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..