1
改良型新药迎来“注册申报的春天”
2020年7月1日起,化学药品、生物制品注册分类正式按照NMPA发布的《化学药品注册分类及申报资料要求》和《生物制品注册分类及申报资料要求》实施。
对于其中2类新药——改良型新药如何开展临床试验?CDE在2020年12月31日关于发布《化学药品改良型新药临床试验技术指导原则》的通告中亦予以明确的路径指导。
在原研已有研发数据的基础上进行处方、剂型、给药途径、适应症等方面的优化,针对未被满足的临床需求,降低成本、缩短临床研发周期进行注册申报,改良型新药正在成为我国注册申报的热点领域。
2
美国改良型新药与创新药发展态势
1) 药物研发技术发展趋势
由美、欧、日主流市场制药公司的发展历程可知,创新药的研发需要人才、资金、技术以及时间的积累,多数国际巨头企业都经历了从普通仿制药、大宗仿制药(全球化仿制药)、高端仿制药、改良型新药到创新药几个阶段。
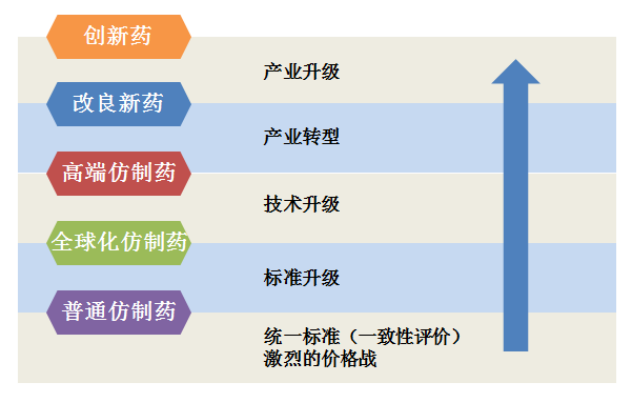
图1化学制药产品发展趋势
来源:北京新领先
在美国,505法案(即《联邦食品、药品、化妆品法案》第5章第505分章)中,化学药品可分为以下3种申请类别,其中NDA包括505(b)(1)和505(b)(2),ANDA为505(j)。

图2美国505(b)法案药品分类
来源:美国FDA网站数据整理
在美国市场,改良型新药发展速度与创新药同步,已成为美国新药市场主力,505(b)(2)申请获批产品数量不断攀升,上市后销售额引人注目。近10年美国通过505(b)(2)申请获批的产品快速增加,2020年申请获批的产品达68个,505(b)(2)途径申报的新药渐成研发主力,改良新药已成药物研发的主力。
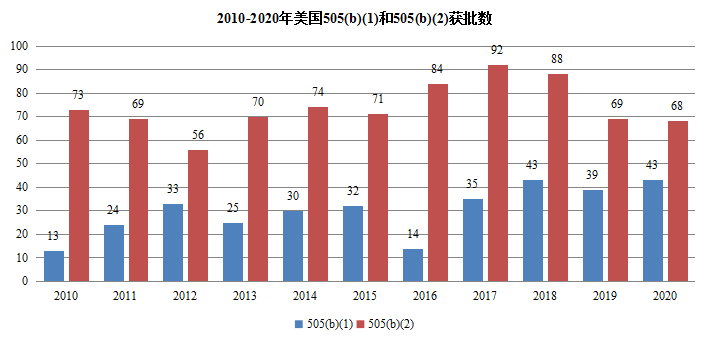
图3近10年化药不同申报类型数量
数据来源:美国FDA网站数据整理
2) 心血管药物改良型新药发展趋势
在心血管领域中,2010-2020年美国FDA共批准NDA 55个,其中505(b)(1)产品13个, 505(b)(2)产品42个,包括复方制剂10个(新复方9个+新分子实体复方1个)、新活性成分4个、新剂型13个(新剂型12个+新活性成分新剂型1个)、新制剂11个,其他2个。
总体而言,在心血管领域的改良型品种中,以复方制剂、新剂型、新制剂为主。
表1 2010-2020年美国FDA批准的心血管领域的改良型品种类别
数据来源:美国FDA网站数据整理
经查询美国审评综述,本领域获批的24个新剂型/新制剂中,4个品种为注射剂,20个品种为口服制剂,总体而言仍然以口服制剂为主。不同品种改良优势汇总如下,主要改良优势为改善依从性(可用于吞咽困难患者)和增加儿童制剂为主。
表2 2010-2020年美国FDA批准的心血管领域改良型新药的主要优势(新剂型/新制剂)

数据来源:美国FDA网站数据整理
主要品种信息如下表所示,其中高血压和心力衰竭药物12个,高血脂药物3个,肺动脉高压药物2个,其他品种4个。
表3 2010-2020年美国FDA批准的心血管领域的改良型新药品种(新剂型/新制剂)
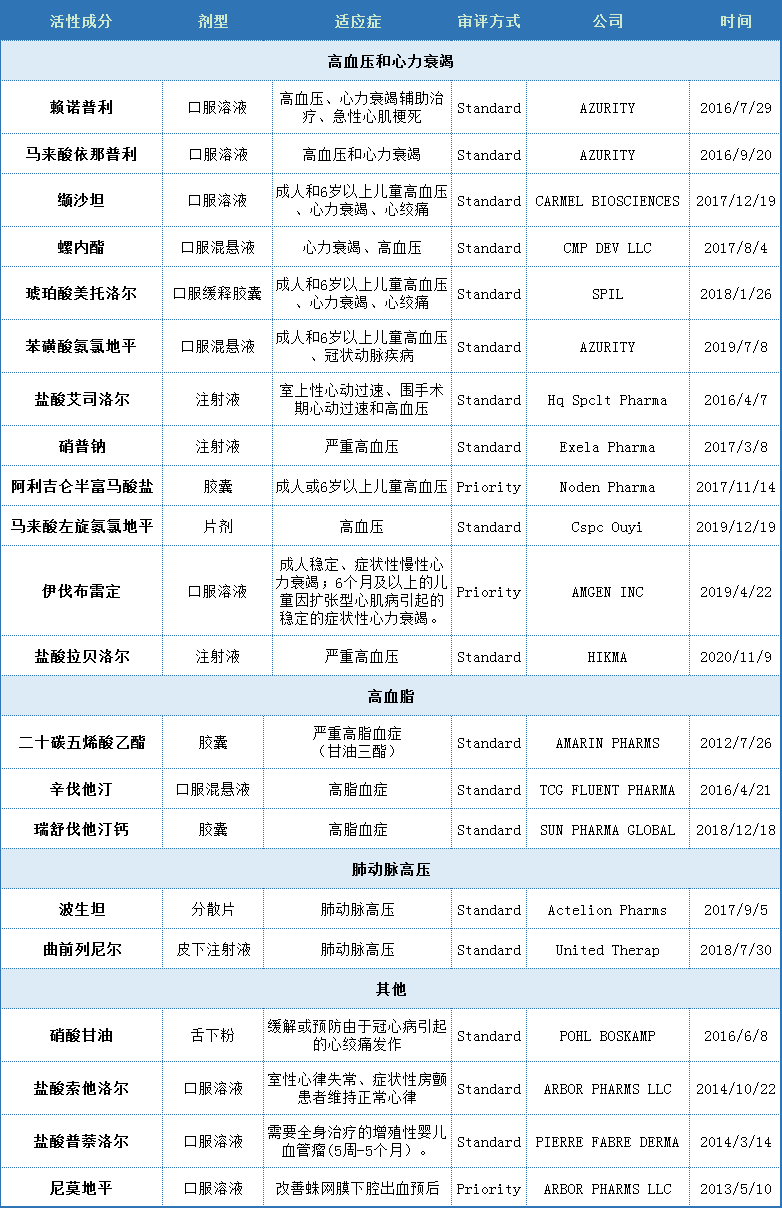
数据来源:美国FDA网站数据整理
由此可见,在心血管领域的改良型新药主要以开发新复方和新剂型/新制剂为主。新剂型/新制剂的主要临床改善为可用于吞咽困难患者和扩大适用人群(儿童)。
3
重点品种的立项和开发策略分析
本文篇幅有限,不能一一赘述,以下选取几个代表性品种分析其立项和开发策略,以期为我们开发心血管领域的改良型品种提供参考:
(1)伊伐布雷定口服溶液-新适应症、新适用人群(儿童)
立项背景与临床需求
Servier和美国被许可人Amgen公司开发了首个选择性、特异性窦房结If通道阻滞剂盐酸伊伐布雷定片和口服溶液,用于成人稳定、症状性慢性心力衰竭,降低因心衰恶化而住院的风险;伊伐布雷定减慢心率的同时不影响心肌收缩力和心脏传导。在2019年4月,伊伐布雷定口服溶液被批准用于治疗6个月及以上的儿童因扩张型心肌病引起的稳定的症状性心力衰竭。此外,对于不能吞咽片剂的患者,可以使用口服溶液剂。
美国FDA的网站未收载本品的审评综述,因此开发内容主要参考美国说明书。
上市后市场表现
本品2019年获批,暂无销售数据。
从我国片剂市场表现来看,2019年销售额约为6011万元,同比增长+190.81%。市场处于快速增长期。口服溶液剂是片剂的补充,可以更好地覆盖全部人群,满足不同的临床需求。
开发成本
非临床试验:未开展新的非临床研究内容,主要参考片剂;
临床试验:开展了1项生物等效性试验和1项儿童PKPD临床试验。
BE试验:相同剂量的口服溶液和片剂口服后,伊伐布雷定和S18982(本品的主要活性代谢产物为N-去甲基化衍生物)生物等效。
PKPD临床试验:由于伊伐布雷定的其他临床试验已经显示,对于扩张型心肌病(DCM)具有改善作用,因此,可以合理推测本品对儿童扩张性心肌病引起的稳定的症状性心力衰竭也有效。在有症状DCM的儿童中进行的多中心、随机、双盲、安慰剂对照试验中评估了Corlanor对心率的影响。70例扩张型心肌病和有症状的慢性心力衰竭儿童患者中,基于体重滴定剂量,评估了伊伐布雷定和S18982的药代动力学。结果显示,在小儿年龄段和成年人中,暴露与心率降低之间的关系相似。小儿患者基于维持剂量后,伊伐布雷定和S18982的稳态暴露与给予5 mg BID的成年心力衰竭患者的暴露相似。
(2)琥珀酸美托洛尔缓释胶囊-可用于吞咽困难的患者
琥珀酸美托洛尔缓释胶囊是Sun Pharma公司开发的505(b)(2)产品,用于高血压、心力衰竭和心绞痛。部分安全性和有效性内容参考了RLD产品Toprol-XL(琥珀酸美托洛尔缓释片)相关内容。
2018年1月26日美国FDA批准本品上市,商品名为Kapspargo Sprinkle,规格为25mg、50mg、100mg和200mg。
立项背景与临床需求
对于所有批准的适应症,本品均为每天单次给药。RLD Toprol-XL®为薄膜包衣片剂(刻痕片),但对于吞咽困难的患者不适用。琥珀酸美托洛尔缓释胶囊不仅可以整吞,而且如果患者吞咽困难,可以打开胶囊后,将其内容物洒在柔软的食物上或通过鼻胃管给药。
开发成本
CMC:多颗粒系统,采用蔗糖微丸上药。
非临床药理毒理学:未开展新的非临床药理毒理学研究。
临床研究:开展了1项开放标签的相对生物利用度研究和1项食物影响研究。
开展了200 mg Toprol-XL 缓释片和200 mg缓释胶囊的生物等效性试验。Cmax和AUCinf(90%置信区间)的几何平均值分别为95.6(91.3,100)和88.3(80.9,96.4)。结果表明,服用缓释胶囊后的暴露与服用Toprol-XL片剂后的暴露相似。25、50和 100 mg胶囊生物等效性试验豁免。
1项食品影响研究表明,高脂肪、高热量的膳食不会改变琥珀酸美托洛尔缓释胶囊的暴露量。另外,与服用完整的胶囊相比,打开胶囊后,与软食品一同服用内容物不会改变暴露。
另外,体外研究显示,将胶囊内容物洒在各种pH值的软食品至少60分钟未降解。当经过鼻胃管给药时,没有药物保留在导管材料上。因此,没有必要进行体内研究来证明给予整个胶囊与通过鼻胃管给药的相对生物利用度。
(3)尼莫地平口服溶液-改善临床使用的便利性
尼莫地平口服溶液由Arbor Pharmaceuticals开发,用于改善蛛网膜下腔出血(SAH)预后,如缺血性神经障碍。部分安全性和有效性内容参考了Nimotop软胶囊(1998年获批)的相关内容。
2013年5月10日美国FDA批准本品上市,商品名为NYMALIZE,规格为60 mg/10 mL 预充式,审评方式为优先审评,此外,cortellis数据库显示,FDA授予了本品Fast Track和Orphan Drug资格。
开发背景和临床需求
尼莫地平是唯一批准用于改善SAH预后的药物,安全性和有效性充分。但在尼莫地平软胶囊Nimotop的说明书中,对于吞咽困难患者的标准做法为使用注射器吸取胶囊填充物后经鼻饲管给药,但存在错误静脉注射的可能性,静脉注射后可能会导致死亡。为了方便临床使用,ARBOR公司开发了尼莫地平口服溶液,可直接用于可吞咽的患者或经鼻饲管或胃管给药,而无需使用注射剂吸取,有助于消除用药错误,规范临床使用。
开发成本
总体而言,本品的开发成本相对较低,仅开展一项非临床研究,未开展临床研究。
非临床研究:由于6种杂质限度高于阈值,因此开展了一项非临床研究评估杂质和降解产物的安全性。Sprague-Dawley大鼠为期14天经口给药(最高120mg/kg/天)的毒理学研究中,大鼠给予新制和久制样品后,毒理学表现相似。考虑到尼莫地平临床使用时间有限,因此两周的毒理学研究评价杂质的安全性是充分的,与人类最大日剂量相比,提供了2-7倍的安全阈值。未开展其他非临床药理和毒理学研究。
临床研究:未开展新的临床研究。主要依据:1)与已获批的胶囊内容物等效;2)无影响生物利用度的非活性成分。
其他特殊说明书:根据美国说明书,尼莫地平口服溶液暂未批准儿童用法用量,但本品是我国《首批鼓励研发申报儿童药品清单》品种,规格为3mg/ml,关注儿童药品的企业可以进一步开发本品,开发扩大适用人群,开发儿童专用产品。
4
小结和建议开发的品种
在国内近年一致性评价+集采的组合拳背景下,普通仿制药利润大幅下降。想要继续在心血管领域占据一席之地,除了激烈的价格战外,也可以另辟蹊径,开发新剂型/新制剂,凭借独特的临床优势弯道超车。
√ 仿制立项建议
从仿制的角度考虑,如果仿制美国上市的改良型新药中的新剂型/新制剂,由于大多数原剂型/制剂已在中国上市,新剂型/新制剂与原产品生物等效,因此大部分产品可以豁免验证性临床试验;另外,上述新剂型/新制剂产品中的口服溶液制剂可以豁免BE试验,因此仅开展药学研究即可申报上市,大大降低开发成本。
另外,该领域的较多品种均纳入了《国家鼓励研发申报的儿童药品》,例如尼莫地平(第一批)、普萘洛尔(第二批)、氨氯地平(第二批)、依那普利(第三批)、索他洛尔(第三批)、螺内酯(第三批)口服液体制剂等,建议企业可以重点关注。
综合国内市场表现,建议关注以下有望首仿或者首家的品种,如下表4所示。
表4 建议可以关注的仿制品种

√ 改良型新药立项建议
心血管领域历来是市场竞争最为激烈的领域,也是很多企业的重点布局领域。从美国近10年心血管领域获批的505(b)(2)品种来看,主要有以下改良趋势:
口服制剂:大多数新剂型、新制剂的品种以关注特殊人群的用药需求为主(包括吞咽困难人群和儿童用药);这其中,不乏对大品种的改良,例如氨氯地平、瑞舒伐他汀钙等。
注射剂:主要改良趋势为改善临床使用的便利性,改良型品种较少。
对于其他品种,也可以进行相似的改良型新药设计。
此外,由于心血管类疾病主要是老年疾病,大多数患者合并高血脂、高血压等多种疾病,开发复方制剂一方面可以发挥协同作用,另外也有助于减少用药负担,提高患者的依从性。
从开发成本角度考虑,新剂型与新制剂大多数未开展新的非临床研究,临床研究部分仅开展生物等效性试验。相对于创新药的开发,成本大大降低,开发成功率较高,值得进一步的深入探索。
作者简介
黄晓敏,北京新领先医药科技发展有限公司综合信息部副经理,大数据分析中心与国际新产品战略研究中心主任,北京大学药理学硕士,5年以上立项经验的资深情报分析师,精通国内外改良型新药开发策略、首仿药知识产权策略分析、企业产品管线规划等。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..