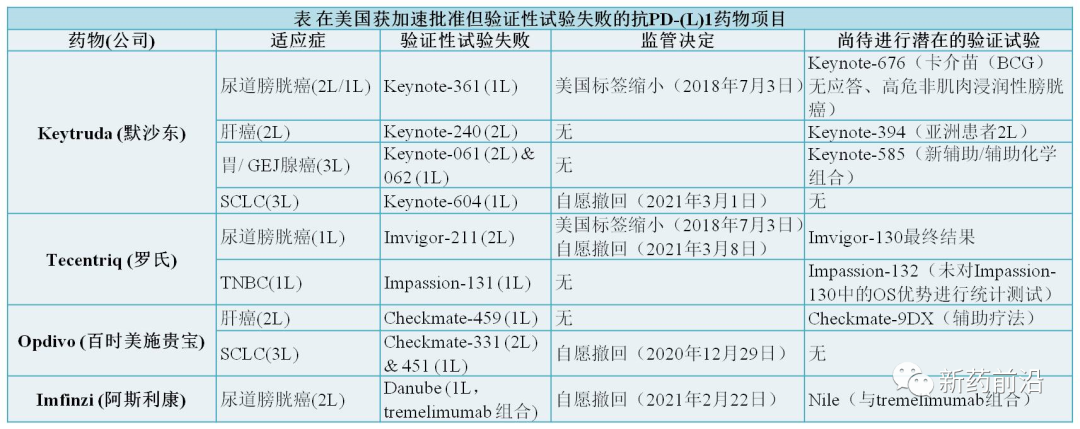
几种PD-(L)1抗癌药物多项适应症尽管通过FDA加速批准计划获得批准上市已数年,但上市后的验证性试验研究未能确认早期的试验结果。虽然,业界人士不断呼吁该机构不应对其监管标准进行妥协,但FDA此前也没有对这些失败研究采取相应行动。
不过直到最近,制药商在确认性试验失败后突然开始加速撤消其PD-(L)1免疫肿瘤疗法的适应症。而作为监管机构的FDA也开始主动出击采取行动了!
回顾:连续4起撤回
1
特善奇/Keytruda
3月8日,罗氏宣布,该公司在与FDA协商后自愿撤回其PD-L1抗体特善奇/Tecentriq(阿特珠单抗)在美国用于先前铂治疗的转移性尿路上皮癌(mUC,膀胱癌)的适应症。
根据IMvigor210研究的结果(Cohort 2),特善奇在2016年获得了加速批准治疗先前用铂治疗的转移性尿路上皮癌。该适应症的完全批准取决于IMvigor211研究的结果,IMvigor211是监管机构对该药物先前用铂治疗的转移性尿路上皮癌适应症的上市后要求(PMR)。该研究未达到其在PD-L1高患者人群中总生存期(OS)的主要终点。随后,FDA将IMvigor130研究指定为上市后要求,该研究将一直持续到最终分析为止。但是,随着先前用铂治疗(二线)转移性尿路上皮癌的新治疗方案的迅速出现,罗氏自愿撤回该适应症。
2
可瑞达/Keytruda
3月1日,默沙东宣布该公司自愿撤回其PD-1单抗可瑞达/Keytruda(帕博利珠单抗)在美国用于治疗接受过铂基化疗或至少一种其他既往治疗线后疾病进展的转移性小细胞肺癌(SCLC)患者适应症。撤回该适应症是与FDA协商完成的,默沙东正在努力在未来几周内完成这一程序。该决定不会影响可瑞达的其他适应症。
根据KEYNOTE-158(cohort G)和KEYNOTE-028(cohortC1)研究的肿瘤缓解率和应答持久性数据,可瑞达于2019年6月获得FDA的加速批准。该适应症完全批准取决于上市后该药物总生存期(OS)的验证性试验结果。2020年1月,该适应症的验证性III期试验KEYNOTE-604研究达到了其联合主要终点之一,即无进展生存期,但另一个主要终点总生存期没有达到统计学意义。
3
英飞凡/Imfinzi
2月22日,阿斯利康宣布,在美国自愿撤回其PD-L1单抗英飞凡/Imfinzi(度伐利尤单抗)用于先前接受过治疗的局部晚期或转移性膀胱癌成年患者适应症。该决定是在与FDA协商后做出的。
2017年5月,英飞凡一项评估用于晚期实体瘤(包括先前治疗过的膀胱癌)安全性和有效性的I/II期Study 1108试验研究中,获得了良好肿瘤缓解率和反应持续时间数据,进而获得了FDA加速批准。该适应症的完全批准取决于英飞凡在一线转移性膀胱癌治疗中III期DANUBE试验的结果,该试验在2020年未达到其主要终点。
4
欧狄沃/Opdivo
2020年12月29日,百时美施贵宝宣布,经与FDA协商,决定从美国市场撤回其PD-1单抗欧狄沃/Opdivo(纳武利尤单抗)用于治疗接受过铂基化疗或至少一种其他既往治疗线后疾病进展的转移性小细胞肺癌患者适应症。
2018年,基于欧狄沃通过对晚期或转移性实体瘤患者替代终点的I/II期CheckMate -032研究,获得了FDA的加速批准。该试验表明,在小细胞肺癌中,使用欧狄沃的应答率和应答持续时间令人鼓舞。但是,随后在不同治疗设置中进行的确认性研究(CheckMate -451和CheckMate -331)未达到其总体生存的主要终点。
随着通过加速批准药物适应症在上市后进行验证性试验研究中可能会遭遇挫折,适应症撤回就难以避免。
展望:下一个适应症撤回会是谁?
最近不到3个月内,连续3起PD-(L)1适应症撤回事件后,该领域其他通过加速批准而在后期验证性试验研究中未取得理想结果的项目可能会面临同样的危险。
例如,默沙东的可瑞达于2018年11月根据II期Keynote-224试验中肿瘤缩小数据获得FDA加速批准,用于先前已接受靶向药物拜耳的多吉美/Nexavar(索拉非尼)治疗的肝细胞癌(HCC)患者。而2019年6月已公布III期Keynote-240临床试验中,可瑞达治疗后患者虽然病情并未恶化,但也未能延长患者的寿命或延长患者的生存时间。
2019年6月,百时美施贵宝的欧狄沃在肝癌适应症中的CheckMate-459试验中遭遇到了类似的挫折。欧狄沃用于先前已接受靶向药物多吉美治疗的肝细胞癌患者适应症于2017年获得FDA加速批准。评估欧狄沃用于不可切除肝细胞癌患者的一线治疗III期CheckMate -459研究的结果显示,该试验的总生存期的主要终点没有统计学意义。尽管CheckMate -459尚未达到其预先指定的主要终点,但结果显示,与目前的治疗标准索拉非尼相比,用欧狄沃治疗的患者的总生存期明显有改善的趋势。
受此影响,2020年1月,欧洲肿瘤内科学会(ESMO)《2019年版肝细胞癌临床实践指南》第3次更新中删除了欧狄沃和可瑞达,其理由分别为:欧狄沃的临床试验CheckMate-459(III期)研究失败,欧狄沃对比索拉非尼未给肝细胞癌患者带来显著的总生存期获益。可瑞达作为二线方案对比安慰剂加最佳支持治疗 KEYNOTE-240(III期)研究未能达到总生存期和无进展生存期(PFS)的共同主要终点,仍有必要等待随机试验的最终结果和更成熟的随访数据。
可瑞达的适应症还包括胃或胃食管交界处腺癌3线疗法。该药物在分别针对先前治疗患者和一线患者的Keynote-061和Keynote-062试验中跌跌撞撞。这两项研究失败记录分别在2017年和2019年,虽然发生在小细胞肺癌验证性试验失败之前,但3线有条件的加速批准适应症仍然存在。
此外,2020年6月9日,默沙东宣布了一项名为KEYNOTE-361的III期临床试验的结果。该研究旨在评估可瑞达联合化疗一线治疗晚期或转移性尿路上皮癌(UC)的疗效,结果显示,与标准化疗相比,可瑞达联合化疗未达到总生存期和无进展生存期的双重主要终点。
到目前为止,尚不清楚FDA在说服这些公司撤回其验证性试验失败的适应症时使用了哪些特定标准。
早在2017年,尽管罗氏的特善奇/Tecentriq(阿特珠单抗)加速批准后III期IMvigor211的临床研究在既往接受含铂化疗期间或化疗后病情进展的局部晚期或转移性尿路上皮癌(mUC)患者中数据显示,与化疗相比,特善奇没有达到提高总生存期的主要终点,但安全性与以往的数据一致。尽管如此,特善奇用于既往未接受治疗(一线治疗)以及不适合顺铂为基础的化疗的膀胱癌患者适应症仍被FDA允许保留。尽管随后FDA将IMvigor130研究指定为上市后要求,但是,随着先前用铂治疗(二线)转移性尿路上皮癌的新治疗方案的迅速出现(如,2020年07月,默克/辉瑞PD-L1疗法Bavencio(avelumab)获得FDA批准用于接受一线含铂化疗病情没有进展的局部晚期或转移性尿路上皮癌患者的维持治疗),罗氏最终自愿撤回该适应症。
尽管目前4起PD-(L)1适应症撤回事件都是企业和FDA协商后自愿撤回的,但监管机构无疑会受到越来越多的质疑和争议,在今后实施加速批准时有可能能会更加审慎。而对于其他抗PD-(L)1药物开发者来说,未来想通过加速批准提前上市的难度或许只会越来越大了。
行动:FDA主动出击
日前,FDA定于 4 月 27 日至 29 日举行肿瘤药专家咨询委员会(ODAC)会议,委员会将针对三款癌症免疫疗法 PD-(L)1 药物获得加速批准适应症的未来进行一般性讨论,决定是否应将保留在市场上。该次会议涉及到PD-(L)1 药物的6个适应症。
Tecentriq与紫杉醇结合蛋白联合用于治疗PD-L1表达≥1%无法切除局部晚期或转移性三阴性乳腺癌(TNBC)成人患者(4月27日)。
Keytruda用于治疗无法进行常规顺铂化疗的局部晚期或转移性尿路上皮癌患者(4月28日)。
Tecentriq用于治疗无法进行常规顺铂化疗的局部晚期或转移性尿路上皮癌患者(4月28日)。
Keytruda用于氟嘧啶-含铂的化学疗法,以及HER2/neu靶向治疗(如果适用)治疗后疾病进展的局部晚期或转移性胃或胃食管交界处(GEJ)腺癌,且其肿瘤表达PD-L1 [合并阳性评分(CPS)≥1] (4月29日)。
Keytruda用于治疗先前已使用索拉非尼治疗的肝细胞癌(HCC)患者(4月29日)。
Opdivo作为单一疗法,用于治疗先前已使用索拉非尼治疗的肝细胞癌(HCC)患者(4月29日)。
届时也许才是监管机构开始主动采取行动,决定PD-(L)1 药物获得加速批准适应症命运的时刻。
延伸阅读:PD-(L)1成加速批准最大受益者
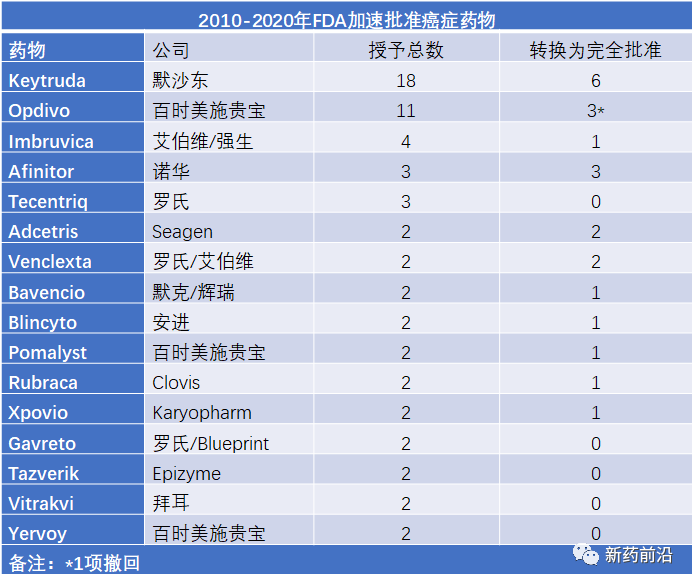
自2010年以来,在FDA的130项加速批准中,肿瘤学占绝大多数,有82%的加速批准涉及癌症药物。
近几年以PD-(L)1为代表的免疫疗法在多种癌症适应症中攻城拔寨,使加速批准在该类药物上市审批中的作用发挥得淋漓尽致。
FDA的最新数据显示,在过去的11年里(2010-2020年),默沙东获得了18项批准是通过加速批准获得的,比任何其他公司都多。一个更令人惊讶的事实是,默沙东所获得的这些加速批准都只涉及一种药物:Keytruda。自2010年以来,Keytruda已获得美国14%的加速批准。
在这方面,默沙东是独一无二的,但它并不是唯一一家广泛获得加速批准这种特殊审批途径的公司。在这种旨在使真正未得到满足疾病的药物仅在替代终点的支持下获得绿色通道的审批途径中,罗氏和百时美施贵宝等公司也应用很广泛。
百时美施贵宝的Opdivo的11项附条件批准,紧随Keytruda的18项。Opdivo的加速批准中只有3个通过确认性试验得到了完全批准,包括2016年获得批准的三线经典霍奇金淋巴瘤适应症尚未转换。
除了Opdivo,百时美施贵宝的加速批准还包括Yervoy,Sprycel和新基(已被百时美施贵宝并购)的Pomalyst和Istodax。
罗氏公司是加速批准程序的另一个主要用户,已将其用于Alecensa,Perjeta,Polivy,Rozlytrek,Tecentriq(三项)和Gavreto(两项);前两种药物已被转化为完全批准。
自2010年以来,只有23项加速批准涉及非癌症药物,共计17种独立产品,其中只有两种,即诺华的Exjade和勃林格殷格翰的Praxibind,在验证性试验的支持下已转换为完全批准。
其中加速批准也面临着争议。最有争议的也许是Sarepta的2种杜氏肌营养不良症外显子跳跃疗法,分别在2016年和2019年获得加速批准的Exondys 51和Vyondys 53。Exondys验证性的MIS51ON研究只是在FDA严厉批评之后才于去年开始,而后者的Essence研究估计直到2024年才会有结果。然而,根据全球医药健康领域领先的行业咨询及市场调研机构EvaluatePharma预测,基于脆弱的替代指标,这两种药物的合并销售额有望超过5亿美元。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..