在刚刚过去的2月份,美国食品与药品监督管理局(FDA)批准了8款新药上市,其中7款为相关领域内首创新药,1款为CAR-T细胞疗法。在国内,国家药监局药品审评中心(CDE)将3款产品纳入了突破性治疗品种目录,其中两款为PD-L1单抗,一款为BCMA CAR-T细胞疗法。
8款新药获FDA批准
NO.1
药品名称:Pepaxto
获批时间:2月26日
标签:首个抗癌肽偶联药物
疾病:多发性骨髓瘤
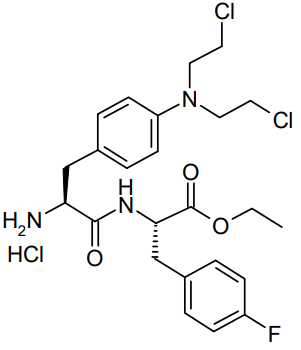
分子结构
2月26日,FDA加速批准了Oncopeptides旗下静脉注射产品Pepaxto(melphalanflufenamide,又名melflufen),与地塞米松联用,治疗复发性或难治性多发性骨髓瘤的成人患者。这些患者此前至少接受过四种疗法,并且对至少一种蛋白酶体抑制剂、免疫调节剂、靶向CD38的单克隆抗体不耐受。
这是FDA批准的首个抗癌肽偶联药物(peptide drug conjugate)。Oncopeptides通过创新技术将烷化剂与靶向氨肽酶的多肽偶联在一起。在一项涉及15例复发性或难治性多发性骨髓瘤患者的2期研究中,经过该药物治疗的患者疾病总缓解率为23.7%,中位缓解持续时间为4.2个月。
NO.2
药品名称:NULIBRY
获批时间:2月26日
标签:首个治疗MoCD的创新疗法
疾病:A型钼辅因子缺乏症
2月26日,FDA批准了OriginBiosciences旗下注射制剂Nulibry (fosdenopterin),用于治疗A型钼辅因子缺乏症(MoCD)这一罕见的遗传疾病。这是一种环吡喃蝶呤单磷酸(cPMP)底物替代疗法,也是FDA针对MoCD批准的首个疗法。
MoCD A型是一种常染色体隐性遗传的先天性代谢障碍,患者无法自主产生环吡喃蝶呤单磷酸(cPMP)。这种疾病进展十分迅速,婴儿死亡率极高,即使存活患者也可能会遭受不可逆的神经损伤。Nulibry能够代替患者体内丢失的cPMP,13名接受该疗法的患者三年生存率达到了84%。
NO.3
药品名称:AMONDYS 45
获批时间:2月25日
标签:首个外显子45跳跃型DMD靶向药
疾病:杜氏肌营养不良
casimersen结构
2月25日,FDA批准了SareptaTherapeutics公司旗下反义寡核苷酸注射剂Amondys 45 (Casimersen)上市,用于治疗经基因检测证实存在外显子45跳跃的杜氏肌营养不良症(DMD)患者。
这是FDA批准的首个针对这类突变患者的靶向疗法,也是继Exondys 51(eteplirsen)和Vyondys 53(golodirsen)之后,FDA批准的第3个用于RNA外显子跳跃突变DMD的反义寡核苷酸疗法。Sarepta公司透露,这款新疗法在价格方面讲与此前的反义寡核苷酸疗法“相似”。
NO.4
药品名称:COSELA
获批时间:2月12日
标签:首款骨髓保护剂
疾病:广泛期非小细胞肺癌
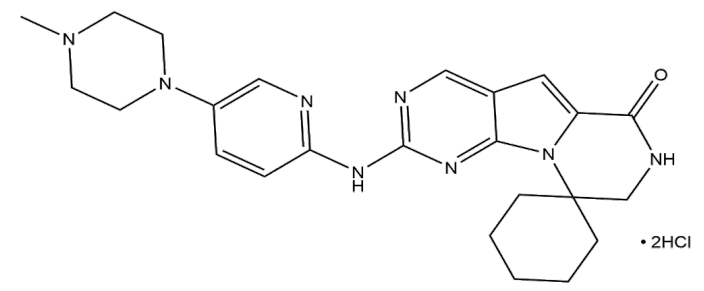
Trilaciclib结构
2月12日,FDA 批准G1Therapeutics 旗下注射制剂Cosela(trilaciclib),用于广泛期非小细胞肺癌(ES-SCLC)成人患者,以降低化疗诱导的骨髓抑制的发生率。通常,化学疗法在杀死癌细胞的同时,也会损害人体正常组织,尤其是骨髓。而Cosela能够通过抑制细胞周期蛋白依赖性激酶4/6,来保护骨髓细胞免受化疗引起的损伤。
据悉,Cosela是全球第一款也是唯一一款可降低化疗诱导的骨髓抑制发生率的骨髓保护疗法。
NO.5
药品名称:EVKEEZA
获批时间:2月11日
标签:首个结合并阻断ANGPTL3的靶向疗法(罕见病)
疾病:纯合子家族性高胆固醇血症
2月11日,再生元旗下“first-in-class”降脂疗法Evkeeza(evinacumab-dgnb)获FDA批准,联合其它降低低密度脂蛋白胆固醇(LDL-C)的疗法,用于治疗12岁及以上的纯合子家族性高胆固醇血症(HoFH)的患者。
人血管生成素样蛋白3基因(ANGPTL3)是一种在脂质代谢中起关键作用的蛋白质,在调节甘油三酯和胆固醇水平上具有关键性作用。而Evkeeza是FDA批准的首个结合并阻断ANGPTL3的靶向疗法,在临床研究中,与接受该疗法的患者比安慰剂组的LDL-C水平降低了49%。
NO.6
药品名称:Breyanzi
获批时间:2月5日
标签:第4款CAR-T疗法
疾病:治疗复发性或难治性弥漫大B细胞淋巴瘤
2月5日,FDA批准百时美施贵宝(BMS)旗下JunoTherapeutics公司开发的CAR-T细胞疗法Breyanzi(lisocabtagene maraleucel),用于治疗复发性或难治性弥漫大B细胞淋巴瘤(DLBCL),这些患者对至少两种其他全身性治疗但是疗效不佳。这是FDA批准的第3款靶向CD19的CAR-T细胞疗法,也是该机构批准的第4款CAR-T细胞疗法。
NO.7
药品名称:UKONIQ
获批时间:2月5日
标签:首款口服PI3Kδ和CK1ε抑制剂
疾病:复发或难治性边缘区淋巴瘤
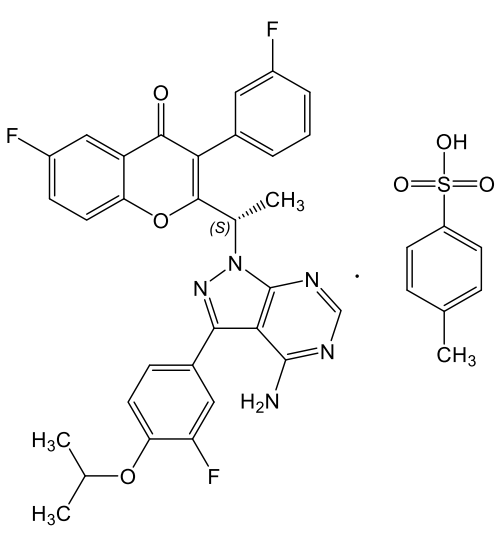
Umbralisib结构
UKONIQ(umbralisib)是首个获得FDA批准的口服用的磷酸肌醇3激酶(PI3K)δ和酪蛋白激酶1(CK1)ε抑制剂,用于治疗至少接受过一次基于抗CD20治疗方案的复发或难治性边缘区淋巴瘤(MZL)成人患者。在2期临床中,接受该疗法的MZL患者客观缓解率(ORR)达49%,完全缓解率达16%。
NO.8
药品名称:TEPMETKO
获批时间:2月3日
标签:首款口服MET抑制剂
疾病:复发或难治性边缘区淋巴瘤
Tepmetko(tepotinib)是德国默克旗下公司EMDSerono研发的高度选择性、每日一次的口服MET抑制剂,FDA批准其用于治疗携带MET基因第14号外显子跳过改变(METex14 skipping)的晚期非小细胞肺癌(NSCLC)成人患者。
3款产品纳入CDE突破性治疗品种
NO.1
纳入时间:2月5日
药品名称:重组全人抗PD-L1单克隆抗体注射液
疾病:接受一线含铂方案疗效不佳的复发转移性宫颈癌
“重组全人抗PD-L1单克隆抗体注射液”(ZKAB001)是李氏大药厂旗下子公司兆科(广州)肿瘤药物有限公司的1类生物新药。CDE于2月5日将其纳入突破性治疗品种,拟定适应症为接受过含铂方案失败或者不能耐受的复发转移性宫颈癌。目前,针对该产品的多项临床试验正在国内开展,其中针对骨肉瘤患者维持治疗的研究已进展至3期阶段。
NO.2
纳入时间:2月5日
药品名称:重组抗PD-L1全人单克隆抗体注射液
疾病:R/R ENKTL
重组抗PD-L1全人单克隆抗体注射液(CS1001,舒格利单抗)是基石药业旗下一款最接近人体的天然G型免疫球蛋白4(IgG4)单抗药物,在人体内产生免疫原性和毒性的风险更低。此次CDE将其纳入突破性治疗品种,拟定适应症为复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)。
NO.3
纳入时间:2月22日
药品名称:BCMA CAR-T注射液
疾病:R/R MM
全人源BCMA嵌合抗原受体自体T细胞(CT103A)注射液由信达生物与驯鹿医疗合作开发,以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a 铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。此次CDE将其纳入突破性治疗品种,拟定适应症为复发/难治性多发性骨髓瘤(R/R MM)。
参考资料:
1.FDA、CDE官网
2.相关企企业官网
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..