近几年来,肿瘤免疫细胞疗法的发展颇为瞩目,特别是CAR-T细胞治疗在血液恶性肿瘤中取得了令人振奋的疗效。鉴于CAR-T的成功,将CAR工程技术沿袭用于其他类型免疫细胞的工程化改造引起了研究者极大的兴趣,由此衍生了CAR-NK、CAR-NKT、CAR-巨噬细胞、CAR-Treg等一系列以CAR技术为核心的新型细胞疗法,以下对这几种细胞疗法的大致情况做个简要介绍。
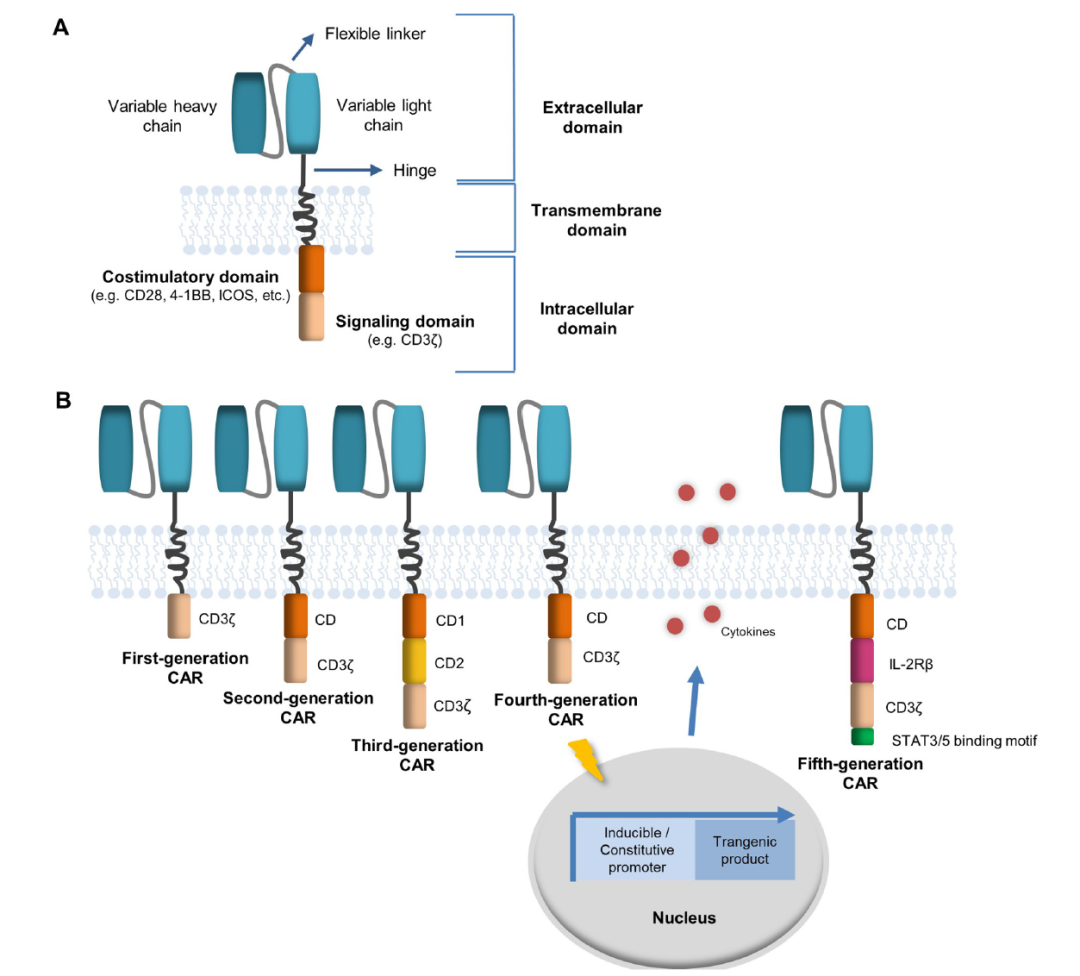
五代CAR的发展(Journal of Controlled Release 319 (2020) 246–261)
CAR-NK
目前,CAR-NK细胞疗法的研究/临床开发热度仅次于CAR-T,在临床方面也已经取得了突破性进展。
较于T细胞,NK细胞作为CAR改造的效应细胞具有很多优良特性。来自异体NK细胞不会引起移植物抗宿主反应(GVHD),这已在许多临床试验中得到证实。NK细胞不分泌引起细胞因子释放综合征的炎症因子,如IL-1、IL-6。CAR-NK细胞除了CAR介导的靶向杀伤之外,还可以通过NK细胞自身抗肿瘤的特性,识别并杀伤CAR靶标下调或缺失的肿瘤细胞,提高免疫治疗效果。
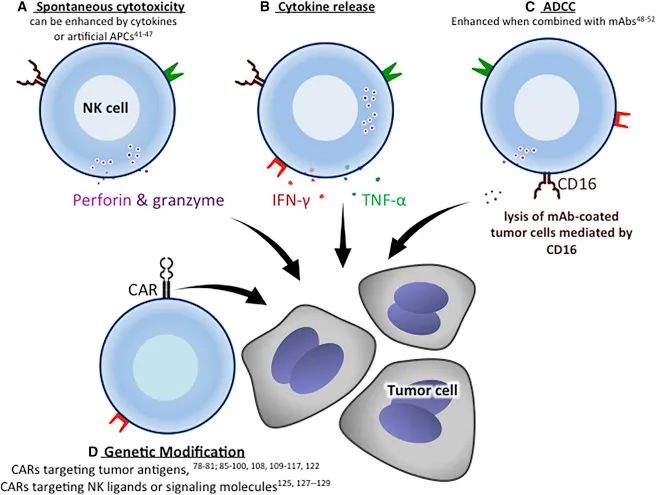
与CAR-T一样,血液肿瘤是CAR-NK临床开发的首要着眼点,今年初(2月8日),来自德克萨斯大学MD安德森癌症中心研究团队在NEJM期刊上发表了其同种异体CD19-CAR-NK细胞疗法的Ⅰ/Ⅱ临床试验研究结果。在该项临床中,CD19-CAR-NK在CD19阳性肿瘤患者中实现了73%总缓解率,64%完全缓解率,输注的CAR-NK细胞扩增并可在低水平下持续至少1年。
在安全性方面,接受治疗的患者均未出现细胞因子释放综合征(CRS)、神经毒性,移植物抗宿主疾病(GvHD)(尽管这些患者与输注的CAR-NK细胞间的HLA不匹配)等不良症状。另外,该临床研究还未出现剂量限制性毒性。
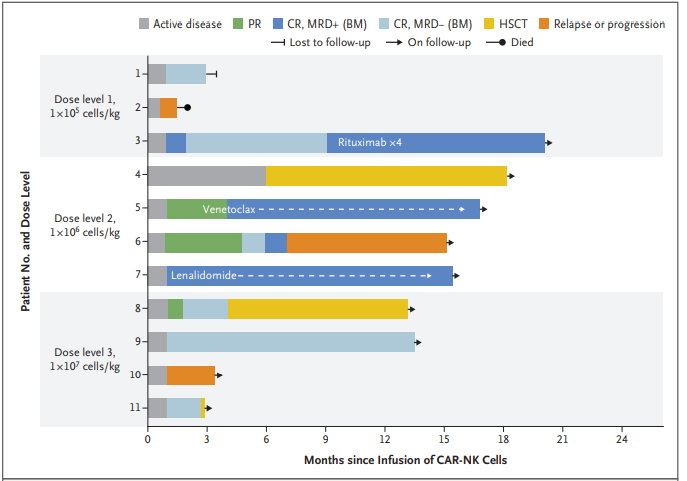
除了血液肿瘤,CAR-NK也用于尝试了CAR-T迟迟未能攻克的实体瘤上。从全球范围内的临床进展来看,中国更为领先取得了实质性的进展,去年7月24日,阿思科力公布,其CAR-NK疗法在复发/难治晚期实体瘤患者中实现了76.5%疾病控制率, 患者的总生存期大于20个月,安全性方面,无一例重大不良反应事件发生。另外,今年5月,科济生物宣布,一名接受治疗的晚期肝癌患者在接受其GPC3-CAR-T疗法后实现了近5年无瘤生存。这一结果极大的鼓舞了在实体瘤中的CAR-NK临床开发。
单从已有CAR-NK公布的临床疗效来看,CAR-NK在血液肿瘤和实体瘤中都已初露锋芒,特别在安全性上,似乎更优于CAR-T。总归来说,现在的CAR-NK与CAR-T相比,前者在临床转化上的进展仍然相对局限,在临床前研究中取得了的进展居多,作为一种真正具有前景的细胞疗法还需要更多的临床数据来支撑。
CAR-NKT
事实上,利用NKT细胞(自然杀伤性T细胞)来开发细胞免疫疗法并不是一种新的概念,在CAR-NKT以前,NKT作为一种过继细胞疗法在临床显示出了疗效。
NKT这种细胞非常稀有,但功能强悍,NKT细胞既表达NK细胞受体也表达T细胞相关受体(TCR),进而兼具NK细胞的非特异性杀伤功能和T细胞的特异性杀伤功能。已有相关研究发现NKT细胞在多种免疫应答的调节中发挥重要作用,包括感染、自身免疫性疾病、代谢性疾病和癌症。
NKT细胞可通过两大途径获得有效的抗肿瘤免疫:直接溶解肿瘤细胞,作为抗肿瘤效应细胞直接发挥抗肿瘤作用。NKT细胞可通过Fas/FasL途径、释放穿孔素、颗粒酶B和肿瘤坏死因子α相关的凋亡诱导配体等途径直接杀伤表达CD1d表达的肿瘤细胞。通过启动Th1细胞因子级联反应来招募和激活其他固有和适应性免疫细胞,间接发挥抗肿瘤作用。除了直接杀伤肿瘤外,NKT细胞激活后可分泌多种细胞因子和激活大量的免疫细胞来间接发挥抗肿瘤免疫作用。
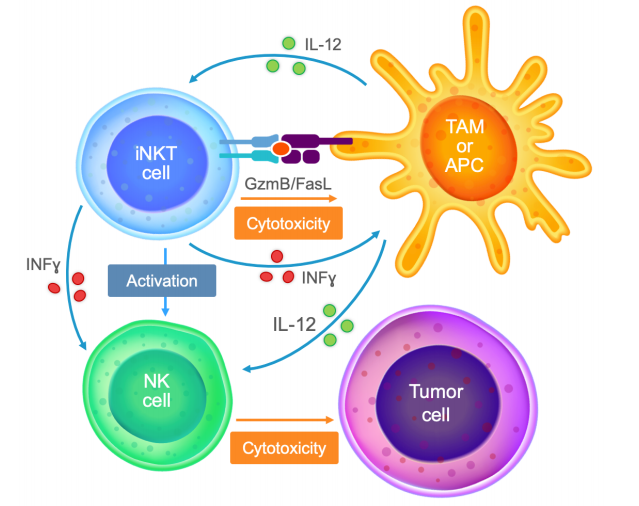
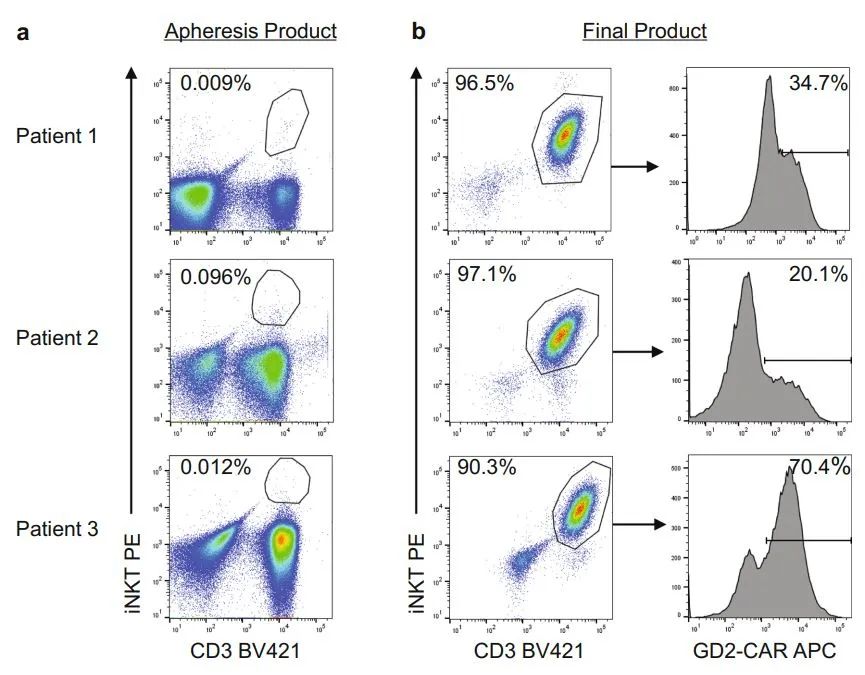
目前在全球范围内,CAR-NKT都处于更早的开发阶段,相关的临床数据甚少。Kuur Therapeutics公司已经率先将其CAR-NKT细胞疗法推进了临床。2020年10月12日,Kuur 在Nature Medicine上公布了其自体靶向GD2-CAR-NKT细胞疗法--KUR-501治疗高危复发性/难治性神经母细胞瘤(R/R NB) GINAKIT2Ⅰ期临床试验的中期结果,结果显示,在接受治疗的三名患者中,有两名在输注KUR-501后肿瘤缩小,一位疾病稳定、一位部分响应。
NKT细胞
有了CAR技术以后,把这种稀有、但又强大的免疫细胞广泛利用起来治疗肿瘤成为可能。激活后的NKT细胞在快速而持久地增强抗肿瘤活性方面具有明显的的优势。因此,对免疫治疗耐药癌症患者来说,NKT细胞疗法可能是一个很好的治疗选择。
CAR-M
近些年来,巨噬细胞的研究也得到了业界的重视,如何激活这些巨噬细胞的抗肿瘤活性是免疫学家一直以来努力的方向。巨噬细胞上的免疫检查点CD47已经为当下肿瘤免疫治疗领域非常有前景的一大热门靶点。不过,靶向这个靶标的CD47抗体药所引起的严重贫血反应(误伤自身正常的红细胞、血小板等)一直是临床开发中长期存在的一大挑战。
除了针对巨噬细胞上相关治疗靶点研究之外,也有人对巨噬细胞作为一种过继性细胞疗法进行了尝试,2017年7月发表在《Current Biology》上的一篇研究中,有研究团队就对巨噬细胞进行了修饰,然后再回输体内,研究结果发现,这种经过改造的巨噬细胞使得实体瘤的生长显著得到抑制,在安全性方面也良好。
今年3月,生物科技初创公司Carisma Therapeutics 在Nature Biotechnology 期刊上在线发表了一篇名为“Human chimeric antigen receptor macrophages for cancer immunotherapy"在 Nature Biotechnology 研究成果。结果显示:在卵巢癌小鼠模型中,CAR-M有效杀伤肿瘤并延长小鼠的总生存期。
在这项新的研究中,研究人员在两个不同的转移性卵巢癌小鼠模型中测试了靶向HER2的CAR-M细胞疗法。结果表明,CAR-Ms在体外显示出了抗原特异性吞噬作用和肿瘤清除活性。在两种实体瘤异种移植小鼠模型中,单次回输CAR-M疗法就能够显著降低肿瘤负荷,并且延长总生存期。
另外在这项研究中还发现,经基因改造的巨噬细胞不但能够靶向吞噬肿瘤细胞,而且还能主动向促炎症的M1巨噬细胞转化,逆转TAM将其向M2巨噬细胞转化。这种疗法还能通过分泌促炎症细胞因子改变了肿瘤微环境,将肿瘤抗原呈现给T细胞,激活T细胞对肿瘤的免疫反应。
去年12月9日,Carisma靶向HER2的CAR-M疗法Ⅰ期临床正式登记,计划入组18例HER2阳性实体瘤患者,这意味着首个CAR-M疗法正式进入临床阶段。此外,另一家MaxCyte公司还开发了CAR-外周血单核细胞(巨噬细胞的前身)--MCY-M11在去年7月已被FDA批准开始临床试验。
总体而言,把巨噬细胞作为用以CAR改造的效应细胞,有望逆转肿瘤抑制性微环境,以此突破免疫细胞疗法在实体瘤中的障碍。
CAR-Treg
Treg 细胞是一群具有负调节机体免疫反应的T细胞,起着维持自身耐受和避免免疫反应过度损伤机体的作用,同时也参与肿瘤细胞逃避机体免疫监视。
不同于上面几种针对肿瘤的CAR-免疫细胞疗法,CAR-Treg旨在针对自身免疫病,通过CAR对Treg细胞的工程化改造使得Treg细胞能够聚集于易受攻击的组织,以抑制其自身免疫反应。
在这方面,TxCell处于领先地位,目前已经开发了HLA-A2 CAR-Treg细胞疗法已经进入临床。
AZTherapies这家早先表现出了对CAR-Treg疗法的兴趣,去年10月25日,这家公司收购了一家拥有调节性T细胞(Treg)技术平台的Smith Therapeutics公司,以利用该平台来开
发工程化Treg细胞疗法,用于治疗,阿尔茨海默病等在内的神经退行性疾病。目前Smith公司已成功开发出靶向大脑神经胶质细胞,具有免疫抑制功能的CAR-Treg疗法。相关研究表明,Tregs在神经退行性疾病小鼠模型中表现出抑制小胶质细胞活性和减少神经炎症的能力。今年4月22日,基因编辑的头部公司Sangamo Therapeutics还与Mogrify就合作开发一种同种异体的CAR-Treg细胞疗法达成了一项协议。
总结
CAR技术的问世为肿瘤免疫治疗打开了一扇全新的大门。CAR-T在血液瘤中已经取得了成功,但是在攻克实体瘤方面举步维艰。
因此,业界已经意识到发挥CAR技术更大的价值不能单单止步于对T细胞的改造上,唤醒NK、NKT、巨噬细胞、Treg细胞这些免疫细胞的抗肿瘤疗效同样值得重视。CAR-NK、CAR-NKT、CAR-巨噬细胞、CAR-Treg等以CAR技术为核心的新型细胞疗法的出现凸显了这项技术的灵活性和可延展性,为整个细胞治疗行业的发展带来更多突破可能。
参考出处
1.https://doi.org/10.1038/s41587-020-0520-5
2.https://www.biospace.com/article/releases/carisma-therapeutics-announces-fda-clearance-of-ind-application-for-first-ever-engineered-macrophage-immunotherapy/?keywords=Carisma+Therapeutics
3.https://www.casmatx.com/approach/
4.https://doi.org/10.1016/j.ymthe.2017.06.012
5.10.1038/s41587-020-0462-y
6.https://carismatx.com/science/
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..