11月23日,默沙东宣布已经向美国FDA和欧盟EMA提交了15价肺炎球菌结合疫苗V114的上市申请,用于18岁以上成人的肺炎球菌感染以及细菌性肺炎的预防。
V114如果获批上市,将会对辉瑞13价肺炎球菌多糖结合疫苗Prevenar 13 (沛儿13)的市场格局造成冲击。因为V114不仅包含了Prevenar 13 的全部13种血清型(1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F),同时增加了2种在老年人侵袭性肺炎球菌疾病中很常见的血清型22F和33F,当前市面上的肺炎疫苗产品均未被覆盖这两种血清型。Prevenar 7/13是辉瑞的当家产品,2019年全球销售收入近60亿美元,对辉瑞整体销售收入的贡献高达11%。
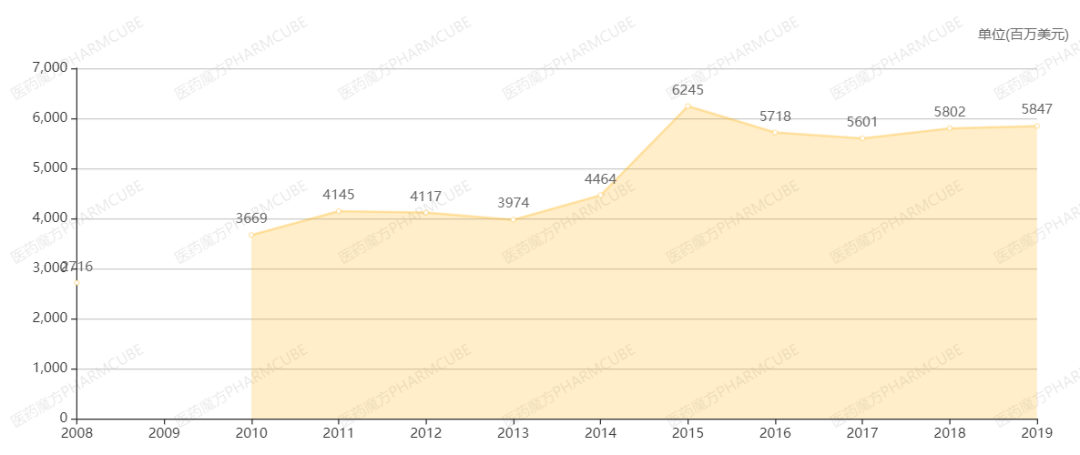
辉瑞Prevenar 7/13疫苗全球历年销售额
来源:NextPharma
V114曾于2019年1月获得FDA授予的突破性疗法资格,用于预防6周~18岁儿科人群以及18岁以上成人的侵袭性肺炎球菌疾病的预防。默沙东此次递交申请主要基于在不同人群中开展的多项II期和III期研究的结果,包括健康人群和高风险人群(比如伴有慢性病、HIV感染人群、65岁以上老年人群)。

肺炎球菌疾病是一种由肺炎球菌感染所引起的疾病类型,其中包括肺炎、鼻窦炎和中耳炎等非侵入性疾病、以及脑膜炎等的侵入性疾病。肺炎球菌有90多种不同类型,它们对成人和儿童影响不同。研究发现,血清型22F和33F引起的侵袭性肺炎球菌疾病与较高的病死率和成人住院时间延长相关。
今年9月,默沙东宣布了两项评估V114安全性和免疫原性的III期研究的一线结果。在III期PNEU-AGE研究中,50岁以上人群接种V114的免疫应答率不劣于PCV13,在对22F和 33F血清型引起的应答方面则V114效果更优。在另一项III期PNEU-TRUE研究中,50岁以上健康受试者接种不同批次V114之后对其覆盖的15种血清型产生了一致的免疫学应答,达到了免疫原性的主要终点。
今年10月,默沙东宣布V114另外两项III期研究成功。一项PNEU-PATH研究共纳入652例50岁以上健康成人,随机接种V114或PCV13疫苗,并在一年后接种Pneumovax 23疫苗。结果显示,2个接种组在接种Pneumovax 23疫苗后对于V114中的15种血清型免疫应答相当。另外,接种V114或PCV13第30天,2组受试者对于疫苗中共有的13个血清型免疫应答相当,V114组受试者对于22F和33F血清型免疫应答更高。
另一项PNEU-DAY研究共纳入1512例18-49岁的受试者,这些受试者因基础疾病或生活习惯导致肺炎球菌疾病风险增加。入组受试者随机接种了V114或PCV13疫苗,并在6个月后接种了Pneumovax 23疫苗。结果显示,V114组与PCV13组受试者对于共有的13种血清型方面免疫应答相当,V114组受试者对于22F和33F血清型免疫应答更高。
默沙东首席医学官、全球临床项目负责人、高级副总裁Roy Baynes博士表示:“一个多世纪以来,默沙东的研发人员开发了有助于应对一些社会重大公共卫生挑战的疫苗,这样的传统在我们的肺炎球菌疫苗产品组合中也得到体现。V114的上市有助于我们在预防肺炎球菌疾病时拥有更多选择。”
面对V114的挑战,辉瑞自然没有束手待毙,其正在大力开发新一代的20价肺炎球菌结合疫苗PF-06482077(20vPnC)。20vPnC疫苗包含了Prevnar 13所包含的全部13种血清型肺炎球菌菌株,以及额外7种在全球范围内引起侵袭性肺病和肺炎的常见血清型肺炎球菌菌株,因此20vPnC几乎覆盖了导致美国和全球肺炎疾病流行的20种主要血清型肺炎球菌菌株,也是辉瑞王牌产品Prevnar 13的升级产品,也曾于2018年9月20日获得FDA突破性疗法认定,用于预防18岁以上成人的肺炎球菌侵袭性疾病和肺炎。
今年3月18日,辉瑞公布了20vPnC一项III期临床研究的顶线结果。该随机、双盲研究(NCT03760146)入组了3880例无肺炎疫苗接种史的18岁以上成人受试者,主要终点是60岁以上人群接种20vPnC、Prevnar 13或PPSV23的免疫效力差异,18岁以上人群接种20vPnC的安全性。次要终点是18~59岁人群接种20vPnC、Prevnar 13或PPSV23的免疫效力差异。
结果显示,60岁以上成人接种20vPnC疫苗1个月后,对Prevnar 13所包含13种血清型肺炎球菌菌株产生的免疫效力不劣于接种Prevnar 13,对PPSV23所包含额外7种血清型肺炎球菌菌株中的6种所产生的免疫效力不劣于接种PPSV23,对其中1种血清型菌株的免疫效力没有达到非劣标准,但差距很小。18-59岁成人接种20vPnC疫苗后,对20种血清型菌株的免疫效力相比对照组均达到非劣标准。18岁以上人群接种20vPnC疫苗后的安全性和耐受性整体良好。
辉瑞还公布了在42~98天新生儿中接种20vPnC的概念性验证结果,表明新生儿接种第3剂20vPnC之后对所有20种血清型都产生了免疫应答。更早年龄段的人群覆盖也是辉瑞应对默沙东挑战采取的措施之一。
辉瑞也曾宣布计划在今年底提交20vPnC的上市申请。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..