Alnylam制药公司是RNAi疗法开发领域的绝对领导者,已推出了2款RNAi药物(Onpattro、Givlaari)。近日,该公司第三款RNAi药物Oxlumo(lumasiran)获得了美国FDA批准,用于治疗原发性高草酸尿症1型(PH1)。
值得一提的是,在批准Oxlumo的同时,
FDA还颁发给Alnylam一张罕见儿科疾病优先审评券(PRV),以奖励该公司在罕见儿科疾病新药研发方面做出的突出贡献。
在上周,Oxlumo也获得了欧盟委员会(EC)批准,用于治疗所有年龄段的PH1患者。PH1是一种极为罕见的疾病,可影响所有年龄段人群,其特点是草酸生成过多,可导致终末期肾病(ESKD)和其他全身并发症。
Oxlumo是第一个个被批准用于治疗PH1的药物,也是唯一一个被证明可以降低有害草酸水平的疗法。在美国,Oxlumo已被
FDA授予治疗PH1的儿科罕见病资格、孤儿药资格(ODD)、突破性药物资格(BTD)。在欧盟,Oxlumo已被授予孤儿药资格(ODD)、优先药物资格(PRIME)。
Oxlumo是第一种显示出显著减少尿草酸排泄量的潜在疗法。3期临床数据显示,Oxlumo治疗显著减少了肝脏中草酸的生成,这可能解决PH1的内在病理生理学问题。Oxlumo的批准上市,将对PH1患者产生有意义的临床影响。
此次批准,基于2项3期临床研究(ILLUMINATE-A,ILLUMINATE-B)的结果。
——ILLUMINATE-A在年龄≥6岁的PH1儿童和成人患者中开展。结果显示,研究达到了主要终点:与安慰剂组相比,Oxlumo治疗组尿草酸水平平均降低53%(p<0.0001)、与基线相比平均降低65%。此外,Oxlumo治疗组有84%的患者尿草酸水平达到正常或接近正常水平,安慰剂组为0%。今年6月,该研究的结果在欧洲肾脏协会-欧洲透析和移植协会(DRA-EDTA)国际大会上公布。
——ILLUMINATE-B研究发现:Oxlumo对婴儿和6岁以下儿童的疗效和安全性与ILLUMINATE-A研究中观察到的结果相似。今年10月22日,该研究结果在美国肾脏病学会(ASN)在线年会上公布。
原发性高草尿酸症1型(PH1)是一种进行性、毁灭性的疾病,由过量的草酸生成导致肾衰竭,具有显著的发病率和死亡率,肝移植是目前唯一解决疾病根源的治疗方法。该病是一种非常罕见的、危及生命的疾病,影响肾脏和其他重要器官,该病影响婴儿、儿童和成人,患者面临着反复和痛苦的结石事件,以及肾功能进行性和不可预测的下降,最终导致终末期肾病,需要进行强化透析,作为肝/肾双重移植的桥梁。PH1通常在儿童期发病,需要立即进行有效的干预,晚期患者除了透析之外别无选择。
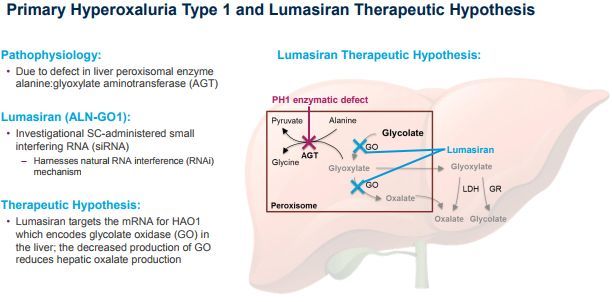
Oxlumo是一种靶向羟基酸氧化酶1(HAO1)的皮下注射RNAi药物,开发用于原发性高草酸尿症1型(PH1)的治疗。HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1和消耗GO酶,Oxlumo可抑制肝脏中草酸(直接参与PH1病理生理学的代谢物)的产生并使其正常化,从而潜在地阻止PH1疾病的进展。
Oxlumo采用了Alnylam公司最新的增强稳定化学ESC-GalNAc共轭技术开发,该技术可使皮下给药具有更强的效力和持久性,并具有一个宽泛的治疗指数。目前,Alnylam公司正在开展另外一项全球性III期研究ILLUMINATE-C,评估Oxlumo治疗伴有晚期肾脏病的所有年龄段PH1患者,预计2021年获得结果。(生物谷Bioon.com)
原文出处:
FDA approves First Drug to Treat Rare Metabolic Disorder